题目内容
3.以下是实验室常用的部分仪器(图1),请回答下列问题:
(1)序号为⑥和⑩的仪器的名称分别为梨形分液漏斗、直形冷凝管.
(2)若用CCl4提取碘水中的碘,必须用到上述仪器中的②⑥(填序号),试描述静置后的现象溶液分为两层,上层呈无色,下层呈紫红色.
(3)能作反应容器且可直接加热的仪器是上述中的试管(填名称).
(4)在配制一定物质的量浓度的溶液时,需要用到的仪器是②④⑧⑨(填序号).
(5)仪器上标有温度的是⑧⑨(填序号).
(6)丙同学想用如图2装置以大理石和稀盐酸反应制取CO2.教师指出,这需要太多的稀盐酸,造成浪费.该同学选用了上述①~⑩中的一种仪器,加在装置上,解决了这个问题.请你把该仪器画在图中合适的位置
 .
.
分析 (1)由图可知仪器的名称;
(2)用CCl4提取碘水中的碘,为萃取原理;
(3)图中给出的仪器只有试管可直接加热;
(4)配制一定物质的量浓度的溶液时,需要容量瓶、胶头滴管、烧杯、量筒等;
(5)容量瓶上标有温度,不能在过高或过低温度下使用,量筒用于量取液体的体积,需要在室温下使用;
(6)漏斗颈太短,产生的二氧化碳气体会从漏斗处泄露,在漏斗颈下加一只小试管,试管内加满稀盐酸后,漏斗被封,多余的盐酸流出与大理石反应,以此来解答.
解答 解:(1)⑥、⑩仪器的名称分别为梨形分液漏斗、直形冷凝管,故答案为:梨形分液漏斗;直形冷凝管;
(2)用CCl4提取碘水中的碘,为萃取原理,必须用到上述仪器中的②⑥,观察到现象为溶液分为两层,上层呈无色,下层呈紫红色,
故答案为:②⑥;溶液分为两层,上层呈无色,下层呈紫红色;
(3)能作反应容器且可直接加热的仪器是上述中的试管,故答案为:试管;
(4)在配制一定物质的量浓度的溶液时,计算、称量、溶解、冷却后转移到容量瓶中定容,需要用到的仪器是②④⑧⑨(⑨可有可无),故答案为:②④⑧⑨;
(5)定量仪器有温度要求,不能受热,需要在常温下进行,如容量瓶、滴定管、量筒等,所以有温度标志的为⑧⑨,故答案为:⑧⑨;
(6)漏斗颈太短,产生的二氧化碳气体会从漏斗处泄露,在漏斗颈下加一只小试管,试管内加满稀盐酸后,漏斗被封,多余的盐酸流出与大理石反应,制取二氧化碳,改进的装置如图为 ,
,
故答案为: .
.
点评 本题考查实验装置的综合应用,为高频考点,把握仪器的使用、混合物分离提纯、实验操作为解答的关键,侧重分析与实验能力的考查,注意(6)为解答的难点,题目难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
2.对四支分别盛有无色溶液的试管,进行如下操作,结论正确的是( )
| 操作 | 现象 | 结论 | |
| A | 滴加氯水和CCl4,振荡、静置 | 下层溶液显紫红色 | 原溶液中有I- |
| B | 滴加BaCl2溶液 | 生成白色沉淀 | 原溶液中一定有SO42- |
| C | 向10mL 0.2mol/LNaOH溶液中先滴入2滴0.1mol/LMgCl2溶液,再滴加2滴0.1mol/LFeCl3溶液 | 先有白色沉淀生成,加入FeCl3溶液后,又有红褐色沉淀生成 | 在相同的温度下的Ksp:Mg(OH)2>Fe(OH)3 |
| D | 滴加稀NaOH溶液,将湿润的红色石蕊试纸置于试管口 | 试纸不变蓝 | 原溶液中一定无NH4+ |
| A. | A | B. | B | C. | C | D. | D |
3. 某有机物的结构简式如图,它可能发生的反应类型有( )
某有机物的结构简式如图,它可能发生的反应类型有( )
①取代 ②加成 ③消去 ④水解⑤酯化 ⑥中和 ⑦氧化 ⑧加聚.
 某有机物的结构简式如图,它可能发生的反应类型有( )
某有机物的结构简式如图,它可能发生的反应类型有( )①取代 ②加成 ③消去 ④水解⑤酯化 ⑥中和 ⑦氧化 ⑧加聚.
| A. | ①②③④⑥ | B. | ②③④⑤⑧ | C. | ③④⑤⑥⑦ | D. | ①②③⑤⑥⑦ |
18.在1200℃时,天然气脱硫工艺中会发生下列反应,则△H4的正确表达式为( )
①H2S(g)+$\frac{3}{2}$O2(g)=SO2(g)+H2O(g)△H1②2H2S(g)+SO2(g)=$\frac{3}{2}$S2(g)+2H2O(g)△H2
③H2S(g)+$\frac{1}{2}$O2(g)=S(g)+H2O(g)△H3④S(g)=$\frac{1}{2}$S2(g)△H4.
①H2S(g)+$\frac{3}{2}$O2(g)=SO2(g)+H2O(g)△H1②2H2S(g)+SO2(g)=$\frac{3}{2}$S2(g)+2H2O(g)△H2
③H2S(g)+$\frac{1}{2}$O2(g)=S(g)+H2O(g)△H3④S(g)=$\frac{1}{2}$S2(g)△H4.
| A. | △H4=$\frac{1}{3}$(3△H3-△H1-△H2) | B. | △H4=$\frac{1}{3}$(△H1+△H2-3△H3) | ||
| C. | △H4=$\frac{3}{4}$(△H1+△H2-3△H3) | D. | △H4=$\frac{3}{4}$(△H1-△H2-3△H3) |
8.工业上曾经通过反应“3Fe+4NaOH $\stackrel{1100℃}{?}$Fe3O4+2H2↑+4Na↑”生产金属钠,己知铁的熔点1535℃、沸点3000℃.下列有关说法正确的是( )
| A. | 每生成1mol H2,转移的电子数约为4NA | |
| B. | 增大铁的量可以使反应速率加快 | |
| C. | 该反应条件下铁的金属性比钠强 | |
| D. | 将生成的气体在空气中冷却可获得钠 |
15.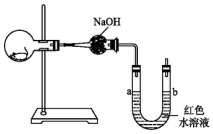 如图所示,烧瓶内有一只活的小白鼠,U形管内装有红色水溶液,使a、b两端的液面处于同一水平面.经数小时后,U形管a、b两处的液面会出现下列哪种情况(实验装置足以维持实验期间小白鼠的生命活动,瓶口密封,忽略水蒸气和温度变化对实验结果的影响)( )
如图所示,烧瓶内有一只活的小白鼠,U形管内装有红色水溶液,使a、b两端的液面处于同一水平面.经数小时后,U形管a、b两处的液面会出现下列哪种情况(实验装置足以维持实验期间小白鼠的生命活动,瓶口密封,忽略水蒸气和温度变化对实验结果的影响)( )
 如图所示,烧瓶内有一只活的小白鼠,U形管内装有红色水溶液,使a、b两端的液面处于同一水平面.经数小时后,U形管a、b两处的液面会出现下列哪种情况(实验装置足以维持实验期间小白鼠的生命活动,瓶口密封,忽略水蒸气和温度变化对实验结果的影响)( )
如图所示,烧瓶内有一只活的小白鼠,U形管内装有红色水溶液,使a、b两端的液面处于同一水平面.经数小时后,U形管a、b两处的液面会出现下列哪种情况(实验装置足以维持实验期间小白鼠的生命活动,瓶口密封,忽略水蒸气和温度变化对实验结果的影响)( )| A. | a端下降,b端上升 | B. | a端上升,b端下降 | C. | a、b两端都下降 | D. | a、b两端都上升 |
12.下列各溶液中,微粒的物质的量浓度关系正确的是( )
| A. | 向硝酸钠溶液中滴加稀盐酸得到的pH=5的混合溶液:c(Na+)=c(NO3-) | |
| B. | 0.1 mol/L NH4Cl溶液:c(NH4+ )=c(Cl-) | |
| C. | 向醋酸钠溶液中加入适量醋酸,得到的酸性混合溶液:c(Na+)>c(CH3COO-)>c(H+)>c(OH-) | |
| D. | 0.1mol AgCl和0.1molAgI混合后加入100mL水中,所得溶液中c(Cl-)=c(I-) |