题目内容
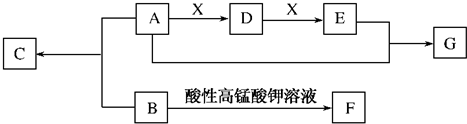
甲、乙、丙、丁分别是Na2CO3、AgNO3、BaCl2、盐酸四种无色溶液中的一种,它们两两反应后的现象如下:甲+乙→沉淀;甲+丙→沉淀;乙+丙→沉淀;丙+丁→沉淀;乙+丁→无色无味气体.则甲、乙、丙、丁四种溶液依次是( )
| A、BaCl2、Na2CO3、AgNO3、盐酸 |
| B、BaCl2、Na2CO3、盐酸、AgNO3 |
| C、Na2CO3、盐酸、AgNO3、BaCl2 |
| D、AgNO3、盐酸、BaCl2、Na2CO3 |
考点:无机物的推断
专题:
分析:乙+丁→无色无味气体.说明为Na2CO3、盐酸;依据反应甲+乙→沉淀;乙+丙→沉淀;乙和甲丙反应生成沉淀,丙十丁→沉淀,判断为乙为Na2CO3;丁为盐酸;丙为AgNO3;甲为BaCl2.
解答:
解:转化关系中乙+丁→无色无味气体,证明乙丁为Na2CO3、盐酸;依据反应:甲+乙→沉淀;乙+丙→沉淀;乙和甲丙反应生成沉淀,丙十丁→沉淀,判断为乙为Na2CO3;丁为盐酸;丙为AgNO3;甲为BaCl2;
故选A.
故选A.
点评:本题考查了物质检验,物质性质的分析应用,乙+丁→无色无味气体的转化是解题关键.

练习册系列答案
 新题型全程检测期末冲刺100分系列答案
新题型全程检测期末冲刺100分系列答案
相关题目
据科学家预测,月球的土壤中吸附着数百万吨的
He,每百吨
He核聚变所释放出的能量相当于目前人类一年消耗的能量.在地球上,氦元素主要以
He的形式存在.下列说法正确的是( )
3 2 |
3 2 |
4 2 |
A、
| ||||
B、
| ||||
C、
| ||||
D、
|
丙烯醇(CH2=CH-CH2OH)可发生的化学反应( )
①加成 ②氧化 ③加聚 ④取代 ⑤置换.
①加成 ②氧化 ③加聚 ④取代 ⑤置换.
| A、①②③ | B、①②④ |
| C、①②③④ | D、①②③④⑤ |
在一定温度下,向容积固定不变的密闭容器里充入a mol N2O4发生如下反应:N2O4 (气)?2NO2 (气),达到平衡后,再向该容器内充入a mol N2O4,达平衡后与原平衡比较正确的是( )
| A、平均相对分子质量增大 |
| B、N2O4的转化率提高 |
| C、压强为原来的2倍 |
| D、颜色变深 |
 MnO4-+
MnO4-+ H2O2+
H2O2+ =
= Mn2++
Mn2++ O2↑+
O2↑+