题目内容
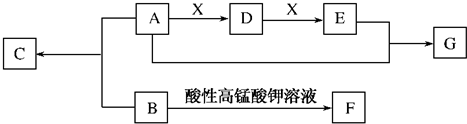
芳香族化合物B、C、F与链状有机物A、D、E间的转化关系如下图所示(以下变化中,某些反应条件及产物未标明).B的核磁共振氢谱中有4个峰,其峰面积之比是3:2:2:1.A能与灼热的氧化铜反应,且1molA最多可消耗2mol氧化铜.C、G属于同类有机物,在某条件下,C蒸气密度是氢气的90倍.1mol F与足量碳酸氢钠溶液反应在标准状况下产生气体44.8L.
(1)C的结构简式为 .
(2)写出D发生银镜反应的化学方程式: ,其反应类型是 .
(3)同时符合下列条件的B的同分异构体有 种.
a.能发生水解反应b.能与新制氢氧化铜悬浊液在加热条件下反应c.分子中含有苯环
(4)写出一定条件下F与A发生反应生成高分子化合物的方程式 .

(1)C的结构简式为
(2)写出D发生银镜反应的化学方程式:
(3)同时符合下列条件的B的同分异构体有
a.能发生水解反应b.能与新制氢氧化铜悬浊液在加热条件下反应c.分子中含有苯环
(4)写出一定条件下F与A发生反应生成高分子化合物的方程式
考点:有机物的推断
专题:有机物的化学性质及推断
分析:芳香族化合物B、C、F与链状有机物A、D、E中,A能与灼热的氧化铜反应,则A属于醇,且1molA最多可消耗2mol氧化铜,则A分子中含有2个-OH,A分子中至少含有2个碳原子.A与X连续反应得到E,则X为氧气,D为二元醇,E为二元酸,A与B反应得到C,C与G为同类物质,则B中含有-COOH,B氧化得到F,1mol F与足量碳酸氢钠溶液反应在标准状况下产生气体44.8L,二氧化碳为2mol,则F分子中含有2个-COOH,可推知C分子中至少含有10个碳元素、3个氧原子,在某条件下,C蒸气密度是氢气的90倍,则Mr(C)=90×2=180,而去掉10个碳原子、3个氧原子后剩余的式量为180-120-48=12,故C分子中含有10个碳原子、12个氢原子、3个氧原子,则C的分子式为C10H12O3,故A为HOCH2CH2OH,D为OHC-CHO,E为HOOC-COOH,B分子为C8H8O2,侧链含有1个甲基、1个-COOH,B的核磁共振氢谱中有4个峰,其峰面积之比是3:2:2:1,则B为 ,F为
,F为 ,C为
,C为 ,据此解答.
,据此解答.
 ,F为
,F为 ,C为
,C为 ,据此解答.
,据此解答.解答:
解:芳香族化合物B、C、F与链状有机物A、D、E中,A能与灼热的氧化铜反应,则A属于醇,且1molA最多可消耗2mol氧化铜,则A分子中含有2个-OH,A分子中至少含有2个碳原子.A与X连续反应得到E,则X为氧气,D为二元醇,E为二元酸,A与B反应得到C,C与G为同类物质,则B中含有-COOH,B氧化得到F,1mol F与足量碳酸氢钠溶液反应在标准状况下产生气体44.8L,二氧化碳为2mol,则F分子中含有2个-COOH,可推知C分子中至少含有10个碳元素、3个氧原子,在某条件下,C蒸气密度是氢气的90倍,则Mr(C)=90×2=180,而去掉10个碳原子、3个氧原子后剩余的式量为180-120-48=12,故C分子中含有10个碳原子、12个氢原子、3个氧原子,则C的分子式为C10H12O3,故A为HOCH2CH2OH,D为OHC-CHO,E为HOOC-COOH,B分子为C8H8O2,侧链含有1个甲基、1个-COOH,B的核磁共振氢谱中有4个峰,其峰面积之比是3:2:2:1,则B为 ,F为
,F为 ,C为
,C为 ,
,
(1)由上述分析可知,C的结构简式为,故答案为: ;
;
(2)D发生银镜反应的化学方程式:OHC-CHO+4Ag(NH3)2OH
NH4OOC-COONH4+4Ag↓+6NH3+2H2O,属于氧化反应,
故答案为:OHC-CHO+4Ag(NH3)2OH
NH4OOC-COONH4+4Ag↓+6NH3+2H2O;氧化反应;
(3)B( )的同分异构体同时符合下列条件:
)的同分异构体同时符合下列条件:
a.能发生水解反应,含有酯基,b.能与新制氢氧化铜悬浊液在加热条件下反应,为甲酸形成的酯基,c.分子中含有苯环,可以有1个侧链为-CH2OOCH,可以有2个侧链,为-CH3、-OOCH,有邻、间、对三种位置,故符合条件的同分异构体共有4种,故答案为:4;
(4)一定条件下F与A发生反应生成高分子化合物的方程式为: ,
,
故答案为: .
.
 ,F为
,F为 ,C为
,C为 ,
,(1)由上述分析可知,C的结构简式为,故答案为:
 ;
;(2)D发生银镜反应的化学方程式:OHC-CHO+4Ag(NH3)2OH
| △ |
故答案为:OHC-CHO+4Ag(NH3)2OH
| △ |
(3)B(
 )的同分异构体同时符合下列条件:
)的同分异构体同时符合下列条件:a.能发生水解反应,含有酯基,b.能与新制氢氧化铜悬浊液在加热条件下反应,为甲酸形成的酯基,c.分子中含有苯环,可以有1个侧链为-CH2OOCH,可以有2个侧链,为-CH3、-OOCH,有邻、间、对三种位置,故符合条件的同分异构体共有4种,故答案为:4;
(4)一定条件下F与A发生反应生成高分子化合物的方程式为:
 ,
,故答案为:
 .
.
点评:本题考查有机物推断,综合分析确定C的分子式是关键,侧重考查学生分析推理能力、知识迁移运用能力,注意掌握官能团的性质与转化,难度较大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
甲、乙、丙、丁分别是Na2CO3、AgNO3、BaCl2、盐酸四种无色溶液中的一种,它们两两反应后的现象如下:甲+乙→沉淀;甲+丙→沉淀;乙+丙→沉淀;丙+丁→沉淀;乙+丁→无色无味气体.则甲、乙、丙、丁四种溶液依次是( )
| A、BaCl2、Na2CO3、AgNO3、盐酸 |
| B、BaCl2、Na2CO3、盐酸、AgNO3 |
| C、Na2CO3、盐酸、AgNO3、BaCl2 |
| D、AgNO3、盐酸、BaCl2、Na2CO3 |
下列实验设计和结论相符的是( )
A、加入NaOH溶液并加热,能产生使湿润红色石蕊试纸变蓝的气体,则一定含有N
| ||
| B、将SO2通入溴水,溴水褪色,说明SO2具有漂白性 | ||
| C、某无色溶液中加Ba(NO3)2溶液,再加入稀盐酸,沉淀不溶解,则原溶液中一定有SO42- | ||
| D、在含FeCl2杂质的FeCl3溶液中通入足量Cl2后,充分加热除去过量的Cl2,即可得到较纯净的FeCl3溶液 |
某固体混合物可能含有NH4Cl、KOH、AgNO3、AlCl3中的若干种,加适量水充分搅拌,得无色澄清溶液,取溶液进行如下实验:①蘸取少量原溶液滴在pH试纸上,试纸显蓝色,与标准比色卡比较,pH约为11;②取1mL原溶液加入3滴乙醛,水浴加热,试管内壁出现光亮的“银镜”.根据上述实验现象,以下推测正确的是( )
| A、肯定存在的只有KOH和AgNO3 |
| B、NH4Cl、AlCl3肯定不存在 |
| C、KOH和AlCl3可能存在 |
| D、肯定存在的只有NH4Cl、KOH和AgNO3 |
离子检验的常用方法有三种:下列离子检验的方法不合理的是( )
| 检验方法 | 沉淀法 | 显色法 | 气体法 |
| 含义 | 反应中有沉淀产生或溶解 | 反应中有颜色变化 | 反应中有气体产生 |
| A、NH4+:气体法 |
| B、SO42-:沉淀法 |
| C、H+:显色法 |
| D、Cl-:气体法 |
下列反应中,通过置换反应得到铁的是( )
| A、铜浸入氯化铁溶液中 |
| B、CO通过炽热的氧化铁 |
| C、铝与氧化铁混合加强至高温 |
| D、铜浸入氯化亚铁溶液中 |
除去下列物质中少量杂质的方法正确的是( )
| A、除去苯中溶有的少量苯酚,加入稍过量浓溴水反应过滤 |
| B、除去溴乙烷中混有的溴杂质,加入适量NaOH溶液,振荡分液 |
| C、除去Na2CO3晶体中混有的NaHCO3杂质,置于坩埚中充分加热 |
| D、除去KNO3晶体中混有的NaCl杂质,加水溶解、蒸发结晶、过滤 |