题目内容
将4.6g 金属Na投入水中充分反应后得到200mL的溶液.
(1)写出反应的离子方程式:
(2)反应所得溶液中的OH-的物质的量浓度为: ,反应中转移的电子的数目为 NA.
(1)写出反应的离子方程式:
(2)反应所得溶液中的OH-的物质的量浓度为:
考点:钠的化学性质,化学方程式的有关计算
专题:计算题,金属概论与碱元素
分析:4.6gNa的物质的量=
=0.2mol,Na和水反应生成NaOH和氢气,根据离子方程式书写规则书写钠和水反应的离子方程式,根据方程式中Na和氢氧根离子之间的关系式计算、钠和转移电子之间的关系式计算.
| 4.6g |
| 23g/mol |
解答:
解:4.6gNa的物质的量=
=0.2mol,Na和水反应生成NaOH和氢气,
(1)离子方程式为2Na+2H2O=2Na++2OH-+H2↑,故答案为:2Na+2H2O=2Na++2OH-+H2↑;
(2)设氢氧根离子的物质的量为x,转移电子数目为y,
2Na+2H2O=2Na++2OH-+H2↑转移电子
2mol 2mol 2NA
0.2mol x y
2mol:2mol=0.2mol:x
x=
=0.2mol,其物质的量浓度=
=1mol/L,
2mol:2NA=0.2mol:y
y=
=0.2NA,
故答案为:1mol/L;0.2.
| 4.6g |
| 23g/mol |
(1)离子方程式为2Na+2H2O=2Na++2OH-+H2↑,故答案为:2Na+2H2O=2Na++2OH-+H2↑;
(2)设氢氧根离子的物质的量为x,转移电子数目为y,
2Na+2H2O=2Na++2OH-+H2↑转移电子
2mol 2mol 2NA
0.2mol x y
2mol:2mol=0.2mol:x
x=
| 2mol×0.2mol |
| 2mol |
| 0.2mol |
| 0.2L |
2mol:2NA=0.2mol:y
y=
| 0.2mol×2NA |
| 2mol |
故答案为:1mol/L;0.2.
点评:本题以钠为载体考查物质的量的计算、离子方程式书写,明确离子方程式书写规则、物质之间的关系即可解答,侧重考查学生计算能力,题目难度不大.

练习册系列答案
相关题目
“西北通道”是指从北大西洋、经加拿大北极群岛进入北冰洋、再进入太平洋的航道,是连接大西洋和太平洋的捷径.最新卫星测量结果显示,北极冰层融化加速,“西北通道”有望在2020年通航,要比专家预测提前30年.提前通航的主要原因是( )
| A、二氧化碳增多使太阳辐射到地球表面的能量增多 |
| B、二氧化碳等气体能释放能量,使大气层的温度升高 |
| C、氟氯烃等大量排放,破坏臭氧层引起的 |
| D、二氧化碳、甲烷等温室气体产生温室效应,使大气温度升高,加速冰层融化 |
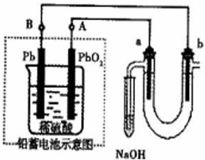 用铅蓄电池电解苦卤水(含Cl-、Br-、Na+、Mg2+)的装置如图所示(a、b为石墨电极).下列说法中正确的是 ( )(填序号)
用铅蓄电池电解苦卤水(含Cl-、Br-、Na+、Mg2+)的装置如图所示(a、b为石墨电极).下列说法中正确的是 ( )(填序号)| A、铅蓄电池负极的反应式为:Pb-2e-=Pb2+ |
| B、铅蓄电池放电时,B极质量减轻,A极质量增加 |
| C、铅蓄电池充电时,A极应与外电源负极相连 |
| D、电解苦卤水时,a电极首先放电的是Br- |
甲、乙、丙、丁分别是Na2CO3、AgNO3、BaCl2、盐酸四种无色溶液中的一种,它们两两反应后的现象如下:甲+乙→沉淀;甲+丙→沉淀;乙+丙→沉淀;丙+丁→沉淀;乙+丁→无色无味气体.则甲、乙、丙、丁四种溶液依次是( )
| A、BaCl2、Na2CO3、AgNO3、盐酸 |
| B、BaCl2、Na2CO3、盐酸、AgNO3 |
| C、Na2CO3、盐酸、AgNO3、BaCl2 |
| D、AgNO3、盐酸、BaCl2、Na2CO3 |
下列各组关于强电解质、弱电解质、非电解质的归类正确的是( )
| A | B | C | D | |
| 强电解质 | Fe | NaCl | BaSO4 | HNO3 |
| 弱电解质 | CH3COOH | NH3 | H2CO3 | Fe(OH)3 |
| 非电解质 | 蔗糖 | CaCO3 | C2H5OH | H2O |
| A、A | B、B | C、C | D、D |
离子检验的常用方法有三种:下列离子检验的方法不合理的是( )
| 检验方法 | 沉淀法 | 显色法 | 气体法 |
| 含义 | 反应中有沉淀产生或溶解 | 反应中有颜色变化 | 反应中有气体产生 |
| A、NH4+:气体法 |
| B、SO42-:沉淀法 |
| C、H+:显色法 |
| D、Cl-:气体法 |
