题目内容
4.将NaHCO3和部分风化的碳酸钠晶体组成的混合物样品m克配成1.00L溶液,取50.0mL上述溶液,加入0.200mol•L-1盐酸至恰好完全反应时,用去盐酸50.0mL.若将上述样品m克加热至质量不变时,可得到固体的质量为( )| A. | 0.53g | B. | 5.30g | C. | 10.6g | D. | 11.7g |
分析 n(HCl)=0.200mol•L-1×0.05L=0.01mol,碳酸氢钠和纯碱晶体与稀盐酸反应都生成NaCl,根据Na、Cl原子守恒得50mL溶液中n(Na+)=n(NaCl)=n(HCl)=0.03mol,1L碳酸钠和纯碱晶体混合溶液中n(Na+)=0.01mol×$\frac{1000mL}{50mL}$=0.2mol,若将上述样品mg加热至质量不变时,剩余固体是碳酸钠,根据Na原子守恒计算碳酸钠质量.
解答 解:n(HCl)=0.200mol•L-1×0.05L=0.01mol,碳酸氢钠和纯碱晶体与稀盐酸反应都生成NaCl,根据Na、Cl原子守恒得50mL溶液中n(Na+)=n(NaCl)=n(HCl)=0.03mol,1L碳酸钠和纯碱晶体混合溶液中n(Na+)=0.01mol×$\frac{1000mL}{50mL}$=0.2mol,
若将上述样品mg加热至质量不变时,剩余固体是碳酸钠,根据Na原子守恒得n(Na2CO3)=$\frac{1}{2}$n(Na+)=$\frac{1}{2}$×0.2mol=0.1mol,
所以加热至质量不变时得到固体质量为:m(Na2CO3)=0.1mol×106g/mol=10.6g,
故选C.
点评 本题考查混合物反应的计算,为高频考点,题目难度中等,正确利用原子守恒是解本题关键,试题培养了学生的分析能力及化学计算能力.

练习册系列答案
相关题目
14.已知:(1)Zn(s)+$\frac{1}{2}$O2(g)═ZnO(s),△H=-348.3kJ/mol
(2)Zn(s)+Ag2O(s)═ZnO(s)+2Ag(s),△H=-317.3kJ/mol
则2Ag(s)+$\frac{1}{2}$O2(g)═Ag2O(s)的△H等于( )
(2)Zn(s)+Ag2O(s)═ZnO(s)+2Ag(s),△H=-317.3kJ/mol
则2Ag(s)+$\frac{1}{2}$O2(g)═Ag2O(s)的△H等于( )
| A. | 31.0kJ/mol | B. | -665.6kJ/mol | C. | 332.8 kJ/mol | D. | -31.0 kJ/mol |
15.为了除去CuCl2酸性溶液中的Fe3+,可在加热搅拌的条件下加入一种试剂,过滤后再向滤液中加入适量盐酸.这种试剂是( )
| A. | 稀氨水 | B. | NaOH溶液 | C. | 硫氰化钾溶液 | D. | Cu2(OH)2CO3固体 |
19.下列物质的俗名与化学式不对应的是( )
| A. | 硅石--SiO2 | B. | 硫铁矿--FeS2 | ||
| C. | 纯碱--NaOH | D. | 芒硝--Na2SO4•10H2O |
9.用NA表示阿伏加德罗常数的值,下列说法正确的是( )
| A. | 高温下,0.2 mol Fe与足量水蒸气反应,生成的H2分子数目为0.3NA | |
| B. | 3.2 g O2和O3的混合气体中氧原子数为0.2NA | |
| C. | 标准状况下,5.6 L CO2与足量Na2O2反应转移的电子数为0.5NA | |
| D. | 过氧化钠与水反应时,生成0.1mol氧气转移的电子数为0.1NA |
16.化学与生活密切相关,下列有关说法错误的是( )
| A. | 食醋可用于除去水垢,食醋的主要成分乙酸属于羧酸 | |
| B. | 75%的酒精可以用于消毒,酒精的主要成分属于醇 | |
| C. | 聚乙烯可用于食品包装,聚乙烯属于烯烃 | |
| D. | 氟利昂是一种制冷剂,氟利昂属于卤代烃 |
13.下列关于化学用语的说法正确的是( )
| A. | Na+的结构示意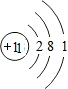 | |
| B. | CO2的结构式:O-C-O | |
| C. | CH4分子的比例模型为: | |
| D. | 用电子式表示氯化氢分子的形成过程:H•+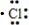 →H+[ →H+[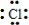 ]- ]- |
 .
.
 .
. 和BrCH2COOC2H5为原料制备
和BrCH2COOC2H5为原料制备 的合成路线流程图
的合成路线流程图