题目内容
9.某探究小组用HNO3与大理石反应过程中质量减小的方法研究影响反应速率的因素.所用HNO3浓度为1.00mol/L、2.00mol/L,大理石有细颗粒与粗颗粒两种规格,实验温度为298K、308K,每次实验HN03的用量为25.0mL、大理石用量为10.00g.(1)请完成以下实验设计表,在实验目的一栏中填出对应的实验编号:
| 试验编号 | T/K | 大理石规格 | HNO3浓度mol/L | 实验目的 |
| ① | 298 | 粗颗粒 | 2.00 | 实验①和②探究HNO3 浓度对该反应速率的影响; (II)实验①和____探究温度对该反应速率的影响; (III)实验①和____探究大理石规格(粗、细)对该反应速率的影响. |
| ② | 298 | 粗颗粒 | 1.00 | |
| ③ | 308 | 粗颗粒 | 2.00 | |
| ④ | 298 | 细颗粒 | 2.00 |

依据反应方程式CaCO3+2HNO3=Ca(NO3)2+CO2↑+H2O,计算实验①在70~90s范围内HNO3的平均反应速率0.01mol•L-1•S-1.(忽略溶液体积变化)
(3)请在图1中,画出实验②和③中CO2质量随时间变化关系的预期结果示意图,并标出线的序号
 此空删去.
此空删去.(4)工业上己实现CO2和H2反应生成甲醇的转化.己知:在一恒温、恒容密闭容器中充入1mol CO2和3molH2,一定条件下发生反应:CO2(g)+3H2(g)=CH3OH(g)+H2O(g).测得CO2和CH3OH (g)的浓度随时间变化如图2所示.请回答:
①达到平衡时H2的转化率为755.在前10min内,用CO2表示的反应速率:V(CO2)=0.075mol/(L•min)
②能判断该反应达到化学平衡状态的依据是ab.
a.容器压强不变 b.混合气体中c(CO2)不变
c.v(CH3OH)=v(H2O) d.c(CH3OH)=c(H2O)
分析 (1)根据实验的目的和影响化学反应速率的因素来设计实验;
(2)由CO2质量随时间变化的关系图得出70-90s二氧化碳的增加量,再根据方程式计算硝酸的量,然后计算实验①在70-90s范围内HNO3的平均反应速率;
(3)根据②、③的硝酸用量及温度、大理石规格,对比①画出实验②和③中CO2质量随时间变化关系的预期结果示意图;
(4)①结合化学平衡三行计算列式计算得到,转化率=$\frac{消耗量}{起始量}$×100%,反应速率v=$\frac{△c}{△t}$;
②根据化学平衡时正逆反应速率相等,各组分含量保持不变分析各选项;
解答 解:(1)由实验目的可知,探究浓度、接触面积对化学反应速率的影响,
则实验①②的温度、大理石规格相同,只有浓度不同,实验①③中只有温度不同,实验①④中只有大理石规格不同,故答案为:
| 实验编号 | T/K | 大理石规格 | HNO3浓度/mol•L-1 | 实验目的 |
| ① | (Ⅱ)③; (Ⅲ)④. | |||
| ② | ||||
| ③ | ||||
| ④ |
由$\frac{1}{2}$CaCO3+HNO3═$\frac{1}{2}$Ca(NO3)2+$\frac{1}{2}$CO2↑+$\frac{1}{2}$H2O可知消耗HNO3的物质的量为n(HNO3)=0.025mol×2=0.05mol,
又溶液体积为25ml=0.025L,所以HNO3减少的浓度△c(HNO3)=0.2mol•L-1,
反应的时间t=90s-70s=20s
所以HNO3在70-90S范围内的平均反应速率为v(HNO3)=$\frac{△c}{△t}$=0.01mol•L-1•S-1,
故答案为:0.01mol•L-1•S-1;
(3)由于②硝酸浓度是①的一半,所以反应速率比①小,生成的二氧化碳是①的一半;
③中的硝酸浓度与①相同,所以生成的二氧化碳物质的量相等,但是温度③最高,反应速率最快,
根据以上画出实验②和③中CO2质量随时间变化关系的预期结果示意图为:
 ,
,故答案为:
 ;
;(4)在一恒温、恒容密闭容器中充入1mol CO2和3molH2,一定条件下发生反应:CO2(g)+3H2(g)=CH3OH(g)+H2O(g).测得CO2和CH3OH (g)的浓度随时间变化如图2所示.生成甲醇浓度0.75mol/L,消耗二氧化碳物质的量浓度=1.00mol/L-0.25mol/L=0.75mol/L,体积为1L,化学平衡三行计算得到,
CO2(g)+3H2(g)=CH3OH(g)+H2O(g).
起始量(mol/L) 1 3 0 0
变化量(mol/L) 0.75 2.25 0.75 0.75
平衡量(mol/L) 0.25 0.75 0.75 0.75
①达到平衡时H2的转化率=$\frac{2.25mol/L}{3mol/L}$×100%=75%,在前10min内,用CO2表示的反应速率:V(CO2)=$\frac{0.75mol/L}{10min}$=0.075mol/(L•min),
故答案为:75%;0.075;
②CO2(g)+3H2(g)=CH3OH(g)+H2O(g)
a.反应前后气体物质的量变化,当容器压强不变,说明反应达到平衡状态,故a正确;
b.混合气体中c(CO2)不变是平衡标志,故b正确;
c.速率之比等于化学方程式计量数之比,v(CH3OH)=v(H2O)反应过程中始终相同,不能说明反应达到平衡状态,故c错误;
d.甲醇和水是生成物,化学方程式中1;1生成,浓度始终相同,c(CH3OH)=c(H2O)不能说明反应达到平衡状态,故d错误,
故答案为:a、b.
点评 本题考查化学反应速率的影响因素、化学反应速率的计算,化学平衡的特征等,注意信息中提高的条件及图象的分析是解答的关键,较好的考查学生综合应用知识的能力,题目难度中等.

练习册系列答案
相关题目
20.下列说法中,正确的是( )
| A. | 铝箔在酒精灯火焰上加热熔化但不滴落,说明铝箔表面氧化铝膜的熔点高于铝 | |
| B. | 向氢氧化铁胶体中加入少量稀硫酸,因发生化学反应而产生红褐色沉淀 | |
| C. | 置换反应不一定都是氧化还原反应 | |
| D. | 标况下,NA个SO2分子和NA个SO3分子体积相同(NA表示阿伏加德罗常数值) |
4. 海洋约占地球表面积的71%,对其开发利用的部分流程如图所示.
海洋约占地球表面积的71%,对其开发利用的部分流程如图所示.
下列说法错误的( )
①试剂1可以选用NaOH溶液
②从苦卤中提取Br2的反应的离子方程式为:2Br -+Cl2=2Cl-+Br2
③工业上,电解熔融MgO冶炼金属镁可减小能耗
④制铝:工业上电解熔融氯化铝来制备铝
⑤制钠:电解饱和NaCl溶液
⑥炼铁:用CO在高温下还原铁矿石中的铁.
 海洋约占地球表面积的71%,对其开发利用的部分流程如图所示.
海洋约占地球表面积的71%,对其开发利用的部分流程如图所示.下列说法错误的( )
①试剂1可以选用NaOH溶液
②从苦卤中提取Br2的反应的离子方程式为:2Br -+Cl2=2Cl-+Br2
③工业上,电解熔融MgO冶炼金属镁可减小能耗
④制铝:工业上电解熔融氯化铝来制备铝
⑤制钠:电解饱和NaCl溶液
⑥炼铁:用CO在高温下还原铁矿石中的铁.
| A. | ①③④⑥ | B. | ②③④⑥ | C. | ①③④⑥ | D. | ①③④⑤ |
1.钙和钠相似,也能形成过氧化物,则下列叙述正确的是( )
| A. | 过氧化钙的化学式是Ca2O2 | |
| B. | 1mol过氧化钠或过氧化钙跟足量水反应都生成0.5mol氧气 | |
| C. | 过氧化钙中钙元素的化合价为+4 | |
| D. | 过氧化钙中属于碱性氧化物 |
18.以下反应最符舍绿色化学原子经济性要求的是( )
| A. | 甲烷与氯气反应制取四氯化碳 | |
| B. | 氯乙烯加聚制取聚氯乙烯高分子材料 | |
| C. | 以铜和浓硫酸为原料制取硫酸铜 | |
| D. | 苯和浓硝酸、浓硫酸的混合物在一定条件下反应制取硝基苯 |
19.标准状况下,11.2LCO2中所含的CO2分子数为( )
| A. | 3.01×1023 | B. | 6.02×1023 | C. | 0.5 | D. | 0.25 |
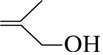 的分子式为C2H8O.
的分子式为C2H8O. 中官能团的名称羟基、羧基.
中官能团的名称羟基、羧基. .
. )为苯的同分异构体,M的二氯代物的同分异构体有3种.
)为苯的同分异构体,M的二氯代物的同分异构体有3种. )具有超强阻隔性能,可作为保鲜食品的包装材料.它是由
)具有超强阻隔性能,可作为保鲜食品的包装材料.它是由 (写结构简式)发生加聚反应生成的.
(写结构简式)发生加聚反应生成的. )与新制的氢氧化铜悬浊液共热的化学方程式:
)与新制的氢氧化铜悬浊液共热的化学方程式: .
. 现有如下两个反应:①NaOH+HCl═NaCl+H2O;②2H2+O2═2H2O.
现有如下两个反应:①NaOH+HCl═NaCl+H2O;②2H2+O2═2H2O.