��Ŀ����
4�� ����Լռ����������71%�����俪�����õIJ���������ͼ��ʾ��
����Լռ����������71%�����俪�����õIJ���������ͼ��ʾ������˵������ģ�������
���Լ�1����ѡ��NaOH��Һ
�ڴӿ�±����ȡBr2�ķ�Ӧ�����ӷ���ʽΪ��2Br -+Cl2=2Cl-+Br2
�۹�ҵ�ϣ��������MgOұ������þ�ɼ�С�ܺ�
����������ҵ�ϵ�������Ȼ������Ʊ���
�����ƣ���ⱥ��NaCl��Һ
����������CO�ڸ����»�ԭ����ʯ�е�����
| A�� | �٢ۢܢ� | B�� | �ڢۢܢ� | C�� | �٢ۢܢ� | D�� | �٢ۢܢ� |
���� ��ˮ���ᴿ�ɵ����Σ���±����ϡ���ᡢ����������2Br-+Cl2=2 Cl-+Br2���������������������壬��������Һ�к��м����ӡ�þ���ӣ������Լ�1�õ�������þ���������Լ�1��Ϊʯ���飬���ξ��ᴿ��Ϊ��Ҫ�Ĺ�ҵԭ�ϣ��������ȼҵ���������Ƶ�ұ�����Դ˽����⣮
��� �⣺��ʯ�����þ���ӷ�Ӧ����������þ�������Լ�1������ԭ����Դ�㷺���ʴ���
�������ܽ�����������Ϊ�嵥�ʣ�Ȼ�������ȡ�ķ�������Һ�л�ȡ�壬��Ӧ�����ӷ���ʽΪ2Br-+Cl2=2 Cl-+Br2������ȷ��
������þ�۵�ܸߣ��Ȼ�þ�۵������þ�ͣ��������þұ��þ���ӳɱ������Թ�ҵ�ϲ��õ�������Ȼ�þ�ķ���ұ��þ���ʴ���
���Ȼ���Ϊ���ۻ��������״̬�²����磬��ҵ�õ���������ķ���ұ�����ʴ���
�ݵ�ⱥ��NaCl��Һ�����������ƺ���������������ҵ�õ�����ڵ��Ȼ��Ƶķ���ұ�����ʴ���
�����Ȼ�ԭ�ķ���ұ������һ����COΪ��ԭ��������ȷ��
��ѡD��
���� ���⿼���˺�ˮ��Դ�Ŀ��������ã�Ϊ��Ƶ���㣬������ѧ���ķ���������ʵ�������Ŀ��飬�漰������ԭ��Ӧ�����ӡ�������ұ����֪ʶ�㣬��ȷ���ʵ������ǽⱾ��ؼ���֪�����ݽ������ǿ��ѡȡ���ʵ�ұ����������Ŀ�ѶȲ���

 �Ķ��쳵ϵ�д�
�Ķ��쳵ϵ�д�| A�� | C2H4��C4H8 | B�� | ����ͱ�ϩ�� | ||
| C�� |  �� �� | D�� | ���Ǻ���ѿ�� |
| A�� | ������ͬ��ԭ�� | B�� | �����Ǽ��ֲ�ͬ���� | ||
| C�� | ��Ԫ�صļ������IJ�ͬ��ʾ���� | D�� | ��ѧ���ʲ�ͬ�ļ�����ԭ�� |
��1�����������ʵ����Ʊ�����ʵ��Ŀ��һ���������Ӧ��ʵ���ţ�
| ������ | T/K | ����ʯ��� | HNO3Ũ��mol/L | ʵ��Ŀ�� |
| �� | 298 | �ֿ��� | 2.00 | ʵ��ٺ͢�̽��HNO3 Ũ�ȶԸ÷�Ӧ���ʵ�Ӱ�죻 ��II��ʵ��ٺ�____̽���¶ȶԸ÷�Ӧ���ʵ�Ӱ�죻 ��III��ʵ��ٺ�____̽������ʯ��֡�ϸ���Ը÷�Ӧ���ʵ�Ӱ�죮 |
| �� | 298 | �ֿ��� | 1.00 | |
| �� | 308 | �ֿ��� | 2.00 | |
| �� | 298 | ϸ���� | 2.00 |

���ݷ�Ӧ����ʽCaCO3+2HNO3=Ca��NO3��2+CO2��+H2O������ʵ�����70��90s��Χ��HNO3��ƽ����Ӧ����0.01mol•L-1•S-1����������Һ����仯��
��3������ͼ1�У�����ʵ��ں͢���CO2������ʱ��仯��ϵ��Ԥ�ڽ��ʾ��ͼ��������ߵ����
 �˿�ɾȥ��
�˿�ɾȥ����4����ҵ�ϼ�ʵ��CO2��H2��Ӧ���ɼ״���ת������֪����һ���¡������ܱ������г���1mol CO2��3molH2��һ�������·�����Ӧ��CO2��g��+3H2��g��=CH3OH��g��+H2O��g�������CO2��CH3OH ��g����Ũ����ʱ��仯��ͼ2��ʾ����ش�
�ٴﵽƽ��ʱH2��ת����Ϊ755����ǰ10min�ڣ���CO2��ʾ�ķ�Ӧ���ʣ�V��CO2��=0.075mol/��L•min��
�����жϸ÷�Ӧ�ﵽ��ѧƽ��״̬��������ab��
a������ѹǿ���� b�����������c��CO2������
c��v��CH3OH��=v��H2O�� d��c��CH3OH��=c��H2O��
| ���� | V2O5 | V2O4 | K2SO4 | SiO2 | Fe2O3 | Al2O3 |
| ��������/% | 2.2��2.9 | 2.8��3.1 | 22��28 | 60��65 | 1��2 | ��1 |

�ش��������⣺
��1���������ʱV2O5ת��ΪVO2+����Ӧ�����ӷ���ʽΪV2O5+2H+=2VO2++H2O��ͬʱV2O4ת����VO2+��������1������Ҫ�ɷ���SiO2��
��2��������������ʹ3mol��VO2+��ΪVO2+������Ҫ������KClO3����Ϊ0.5mol��
| A�� | H2S | B�� | NaOH | C�� | CaCO3 | D�� | HCl |
| A�� | NH4H�����ӻ����� | |
| B�� | NH4H����ˮ��������Һ������ | |
| C�� | NH4H��ˮ��Ӧʱ��ˮ�������� | |
| D�� | NH4H����Ͷ������ˮ�У�������������� |
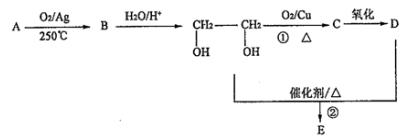
 ��
��