题目内容
(1)将一定量纯净的氨基甲酸铵置于密闭真空容器中(假设容器体积不变,固体试样体积忽略不计),在恒定温度下使其达到分解平衡:H2NOONH4(s)?2NH3(g)+CO2(g)
实验测得不同温度下的平衡数据列于下表:
氨基甲酸铵分解反应的焓变△H 0(填“>”、“<”或“=”)
可以判断该分解反应已经达到化学平衡的是 .(填字母)
A.2v(NH3)=v(CO2)
B.密闭容器中总压强不变
C.密闭容器中混合气体的密度不变
D.密闭容器中氨气的体积分数不变
根据表中数据,计算25.0℃时的分解平衡常数为 .
(2)25℃时,NH3?H2O电离常数Kb=1.8×10-5,Mg(OH)2的溶度积常数Ksp=1.8×10-11,计算0.5mol/L氨水的pH约为 .(已知lg3≈0.5)
在某氯化镁溶液中加入一定量的某浓度的氨水后,测得混合液PH=11,则此温度下残留在溶液中的c(Mg2+)= .
实验测得不同温度下的平衡数据列于下表:
| 温度(℃) | 15.0 | 20.0 | 25.0 | 30.0 | 35.0 |
| 平衡气体总浓度(×10-3mol/L) | 2.4 | 3.4 | 4.8 | 6.8[来源:www.shulihua.net] | 9.4 |
可以判断该分解反应已经达到化学平衡的是
A.2v(NH3)=v(CO2)
B.密闭容器中总压强不变
C.密闭容器中混合气体的密度不变
D.密闭容器中氨气的体积分数不变
根据表中数据,计算25.0℃时的分解平衡常数为
(2)25℃时,NH3?H2O电离常数Kb=1.8×10-5,Mg(OH)2的溶度积常数Ksp=1.8×10-11,计算0.5mol/L氨水的pH约为
在某氯化镁溶液中加入一定量的某浓度的氨水后,测得混合液PH=11,则此温度下残留在溶液中的c(Mg2+)=
考点:用化学平衡常数进行计算,化学平衡状态的判断,难溶电解质的溶解平衡及沉淀转化的本质
专题:
分析:(1)根据表中数据知温度升高,气体的总浓度增大,平衡正向移动;
当化学反应正逆反应速率相等,各组分浓度不变时,反应达到平衡状态;
根据平衡时各组分浓度,由平衡常数公式计算;
(2)由电离平衡常数计算氢氧根离子浓度,根据水的离子积常数计算氢离子浓度,继而计算PH值;
由溶度积常数结合氢氧根离子浓度计算溶液中镁离子浓度.
当化学反应正逆反应速率相等,各组分浓度不变时,反应达到平衡状态;
根据平衡时各组分浓度,由平衡常数公式计算;
(2)由电离平衡常数计算氢氧根离子浓度,根据水的离子积常数计算氢离子浓度,继而计算PH值;
由溶度积常数结合氢氧根离子浓度计算溶液中镁离子浓度.
解答:
解:(1)从表中数据可以看出随着温度升高,气体的总浓度增大,平衡正向移动,则该反应为吸热反应,△H>0;
A、因未指明速率的方向,无法确定正逆反应速率的关系,故A错误;
B、该反应是气体体积增大的反应,故当容器内压强不变时,已达到平衡,故B正确;
C、由于反应物是固体,没有达到平衡状态,气体质量会变化,容器体积不变,密度也会发生变化,所以密度不变,达到了平衡状态,故C正确;
D、因反应物是固体物质,所以密闭容器中NH3的体积分数始终不变,为2/3,故D错误.
容器内气体的浓度之比为2:1,故NH3和CO2的平衡浓度分别为3.2×10-3 mol/L、1.6×10-3mol/L,代入平衡常数表达式K=c(NH3)2?c(CO2)=(3.2×10-3 mol/L)2×1.6×10-3mol/L=1.64×10-8mol3/L3,
故答案为:>;BC;1.64×10-8mol3/L3;
(2)已知氨水电离生成等量的铵根离子和氢氧根离子,NH3?H2O的电离平衡常数K=
=
=1.8×10-5,所以c(OH-)=3×10-3mol/L,则c(H+)=
×10-11,PH=11.5;25℃时,Mg(OH)2的溶度积常数Ksp=1.8×10-11,pH=11,c(OH-)=0.001mol/L,残留在溶液中的c(Mg2+)=
=
=1.8×10-5mol/L,
故答案为:11.5;1.8×10-5mol/L.
A、因未指明速率的方向,无法确定正逆反应速率的关系,故A错误;
B、该反应是气体体积增大的反应,故当容器内压强不变时,已达到平衡,故B正确;
C、由于反应物是固体,没有达到平衡状态,气体质量会变化,容器体积不变,密度也会发生变化,所以密度不变,达到了平衡状态,故C正确;
D、因反应物是固体物质,所以密闭容器中NH3的体积分数始终不变,为2/3,故D错误.
容器内气体的浓度之比为2:1,故NH3和CO2的平衡浓度分别为3.2×10-3 mol/L、1.6×10-3mol/L,代入平衡常数表达式K=c(NH3)2?c(CO2)=(3.2×10-3 mol/L)2×1.6×10-3mol/L=1.64×10-8mol3/L3,
故答案为:>;BC;1.64×10-8mol3/L3;
(2)已知氨水电离生成等量的铵根离子和氢氧根离子,NH3?H2O的电离平衡常数K=
| c(NH4+)c(OH-) |
| c(NH3?H2O) |
| c2(OH-) |
| 0.5 |
| 1 |
| 3 |
| Ksp |
| c(OH -)2 |
| 1.8×10-11 |
| 0.0012 |
故答案为:11.5;1.8×10-5mol/L.
点评:本题考查了化学平衡常数理解应用,化学平衡状态的判断,溶解平衡及溶度积的应用,注重了基础原理的应用,本题难度中等.

练习册系列答案
相关题目
将①H+②Cl-③Al3+④K+⑤O2-五种微粒分别加入水中,基本上不影响水的电离平衡的有 ( )
| A、①②④⑤ | B、②④⑤ |
| C、①③⑤ | D、②④ |
已知充分燃烧7.8g 乙炔气体时生成二氧化碳气体和液态水,并放出热量389.9kJ,则乙炔燃烧的热化学方程式正确的是( )
| A、2C2H2(g)+5O2(g)=4CO2(g)+2H2O(l)△H=-389.9 kJ/mol | ||
B、C2H2(g)+
| ||
| C、2C2H2(g)+5O2(g)=4CO2(g)+2H2O(g)△H=-2599.2 kJ/mol | ||
| D、2C2H2(g)+5O2(g)=4CO2(g)+2H2O(l)△H=-1299.6 kJ/mol |
可以把 转变成
转变成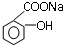 的方法是( )
的方法是( )
 转变成
转变成 的方法是( )
的方法是( )| A、加入足量的NaOH(aq)并加热 |
| B、与足量NaOH(aq)共热后,通入足量CO2 |
| C、与盐酸共热后,加入足量的NaOH(aq) |
| D、与稀硫酸共热后,加入足量Na2CO3 (aq) |
实验室需配制一种仅含五种离子(不考虑水解和水电离出的离子)的混合液,且在混合液中五种离子的物质的量浓度均为 5mol/L,下面四个选项中能达到此目的是( )
| A、Na+、K+、SO42-、NO3-、Cl- |
| B、Fe2+、H+、Br-、NO3-、Cl- |
| C、Ca2+、K+、OH-、Cl-、NO3- |
| D、Al3+、Na+、Cl-、SO42-、NO3- |

