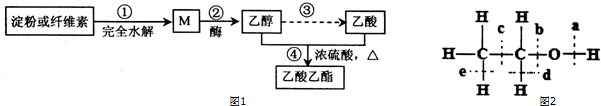
题目内容
11.下列化学用语正确的是( )| A. | 氯化钠的电子式: | B. | 磷原子的结构示意图: | ||
| C. | 乙烯的结构简式CH2CH2 | D. | 乙酸的分子式C2H4O2 |
分析 A.氯化钠为离子化合物,电子式中需要标出阴阳离子所带电荷;
B.磷原子核外电子总数为15,最外层为5个电子;
C.乙烯的结构简式必须表示出碳碳双键;
D.乙酸结构简式为CH3COOH,据此书写分子式.
解答 解:A.氯化钠为离子化合物,钠离子直接用离子符号表示,氯离子需要标出最外层电子及所带电荷,氯化钠正确的电子式为: ,故A错误;
,故A错误;
B.磷原子的核电荷数=核外电子总数=15,最外层为5个电子,磷原子正确的结构示意图为: ,故B错误;
,故B错误;
C.乙酸结构简式应该为:CH2=CH2,故C错误;
D.乙酸为一元羧酸,结构简式为CH3COOH,分子式为C2H4O2,故D正确;
故选D.
点评 本题考查常见化学用语的正误判断,题目难度不大,主要是考查学生对常见化学用语的熟悉掌握程度,平时需注意常见的化学用语主要包括元素符号、化学式、化合价、电子式、原子结构示意图、结构式、结构简式以及方程式和各种模型等.

练习册系列答案
 期末宝典单元检测分类复习卷系列答案
期末宝典单元检测分类复习卷系列答案
相关题目
1.下列各元素中,一定属于主族元素的是( )
| A. | X元素能形成+7价的含氧酸及其盐 | |
| B. | Y元素原子最外层电子数为2 | |
| C. | Z元素的阴离子与同一周期稀有气体元素的原子电子层结构相同 | |
| D. | R元素的最高价氧化物是酸性氧化物 |
19.下列混合物,能用分液漏斗分离的是( )
| A. | 酒精和水 | B. | 食盐和水 | C. | 酱油和汽油 | D. | 芝麻和黄豆 |
6.设NA代表阿伏加德罗常数的值,下列说法正确的是( )
| A. | 1 mol NH4CI 固体中共价键总数为5NA | |
| B. | 16g O2与O3的混合物中含有NA个氧原子 | |
| C. | 向装有催化剂的密闭容器加入3molH2和1 mol N2,充分反应后得2NA 个氨分子 | |
| D. | 18g水(H2O)含有8NA个中子 |
16.1mol有机物甲,水解后得2molC2H6O和1molC2H2O4,该有机物是( )
| A. | CH3OOCCH2COOC2H5 | B. |  | ||
| C. | CH3COOCH2CH2COOCH3 | D. | CH3COOCH2COOC2H5 |
1.为探究Na、Mg、Al的金属活动性顺序,某课外小组同学进行了如下实验:
他们记录的实验现象有:
请帮助该小组同学补充下列实验报告中的内容.
(1)在下表中填写与实验相对应的实验现象序号:
(2)写出钠与水反应的化学方程式2Na+2H2O=2NaOH+H2↑.
(3)实验结论是金属活动性顺序为Na>Mg>Al.
(4)用原子结构理论对上述实验结论进行解释:同周期元素从左至右,原子的电子层数相同,核电荷数逐渐增多,原子半径逐渐减小,原子核对电子的引力逐渐增强,失电子能力逐渐减弱,因此金属性逐渐减弱.
| 实验 | ①将一小块金属钠放入滴有酚酞溶液的冷水中 ②将一小段用砂纸打磨后的镁带放入试管中,加入少量水,加热至水沸腾,冷却后,向试管中滴加酚酞溶液. ③将一小段镁带投入稀盐酸中 ④将一小片铝投入稀盐酸中 |
| 实验 现象 | ①剧烈反应,迅速生成大量的气体. ②浮在水面上,熔成小球,不断游动,小球渐小最终消失,溶液变红. ③反应不剧烈,产生无色气体. ④有气体产生,溶液变成红色. |
(1)在下表中填写与实验相对应的实验现象序号:
| 实验 | 1 | 2 | 3 | 4 |
| 实验现象 |
(3)实验结论是金属活动性顺序为Na>Mg>Al.
(4)用原子结构理论对上述实验结论进行解释:同周期元素从左至右,原子的电子层数相同,核电荷数逐渐增多,原子半径逐渐减小,原子核对电子的引力逐渐增强,失电子能力逐渐减弱,因此金属性逐渐减弱.
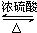 CH3CO18OCH2CH3+H2O.
CH3CO18OCH2CH3+H2O.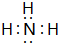 .e3z与盐酸反应生成2种盐,其中热稳定性最差的生成盐的电子式为
.e3z与盐酸反应生成2种盐,其中热稳定性最差的生成盐的电子式为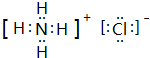 .
.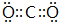 .z单质的电子式为
.z单质的电子式为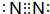 ,其结构式为N≡N.e和d形成原子个数为1:1的化合物的电子式为
,其结构式为N≡N.e和d形成原子个数为1:1的化合物的电子式为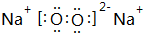 .用电子式表示x和d原子个数为1:1的化合物的形成过程
.用电子式表示x和d原子个数为1:1的化合物的形成过程 .
.