题目内容
13.下面六个图中,横坐标为某溶液中加入某物质的量,纵坐标为生成沉淀的量.从A-F中选择符合表中各题要求的序号填入表中: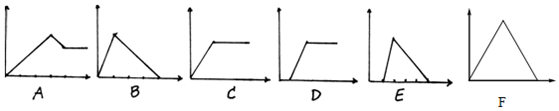
| 溶 液 | 加入的物质 | 答案序号 |
| (1)饱和石灰水 | CO2 | |
| (2)AlCl3溶液 | 过量NH3 | |
| (3)含少量NaOH的NaAlO2 | 过量CO2 | |
| (4)含少量NaOH的NaAlO2 | 逐滴加稀盐酸 | |
| (5)MgCl2、AlCl3混合液 | 逐滴加NaOH至过量 | |
| (6)NaOH溶液 | 逐滴加AlCl3至过量 |
分析 (1)石灰水中通入二氧化碳,先生成沉淀,后沉淀消失,根据方程式判断前后两部分二氧化碳的物质的量关系;
(2)氯化铝中加入氨气生成氢氧化铝沉淀,沉淀不能溶解在过量氨水中;
(3)NaOH和NaAlO2的混合溶液中通入二氧化碳,先发生氢氧化钠与二氧化碳的反应,不生成沉淀,再发生NaAlO2与二氧化碳反应,生成沉淀;
(4)含少量NaOH的NaAlO2溶液中加入稀盐酸,先发生氢氧化钠与盐酸的反应,后生成氢氧化铝沉淀,最后沉淀溶解,根据方程式判断前后两部分两部分消耗的盐酸体积;
(5)MgCl2和AlCl3混合溶液中滴加NaOH溶液生成两种沉淀,然后氢氧化铝与碱反应使沉淀的量减少,但不会完全溶解;
(6)NaOH溶液逐滴加AlCl3至过量,首先将氢氧根离子转化为偏铝酸根离子,然后偏铝酸根与铝离子发生双水解.
解答 解:(1)石灰水中通入二氧化碳,先发生Ca(OH)2+CO2═CaCO3↓+H2O,生成沉淀,后发生CO2+CaCO3+H2O═Ca(HCO3)2,沉淀消失,前后两部分二氧化碳的物质的量为1:1,故图象F符合;
(2)氯化铝中加入氨水生成氢氧化铝沉淀,沉淀不能溶解在过量氨水中,发生的反应为Al3++3OH-═Al(OH)3↓,故图象C符合;
(3)NaOH和NaAlO2的混合溶液中通入二氧化碳,先发生反应2NaOH+CO2═Na2CO3+2H2O,开始不产生沉淀,NaOH溶液完毕,再发生2NaAlO2+CO2+3H2O=2Al(OH)3↓+Na2CO3,生成沉淀,故图象D符合;
(4)含少量NaOH的NaAlO2溶液中加入稀盐酸,先发生氢氧化钠与盐酸的反应,后生成氢氧化铝沉淀,最后沉淀溶解,而后两阶段NaAlO2溶液中加入稀盐酸,发生反应NaAlO2+HCl+H2O=Al(OH)3↓+NaCl,生成氢氧化铝沉淀,NaAlO2反应完毕后,发生反应,Al(OH)3+3HCl=AlCl3+3H2O,氢氧化铝溶解,前后两部分消耗的盐酸体积为1:3,故图象E符合;
(5)MgCl2和AlCl3混合溶液中滴加NaOH溶液发生Al3++3OH-═Al(OH)3↓、Mg2++2OH-═Mg(OH)2↓生成两种沉淀,然后发生Al(OH)3+NaOH═NaAlO2+2H2O,沉淀量减少但不会完全溶解,故图象A符合;
(6)NaOH溶液逐滴加AlCl3至过量,首先将氢氧根离子转化为偏铝酸根离子,然后偏铝酸根与铝离子发生双水解,所以先无沉淀,后沉淀逐渐增多,最后达最大量,故图象D符合,故答案为:
| 溶 液 | 加入的物质 | 答案序号 |
| (1)饱和石灰水 | CO2 | F |
| (2)AlCl3溶液 | 过量NH3 | C |
| (3)含少量NaOH的NaAlO2 | 过量CO2 | D |
| (4)含少量NaOH的NaAlO2 | 逐滴加稀盐酸 | E |
| (5)MgCl2、AlCl3混合液 | 逐滴加NaOH至过量 | A |
| (6)NaOH溶液 | 逐滴加AlCl3至过量 | D |
点评 本题以图象显示考查化学反应,难度中等,明确发生的化学反应是解答的关键,注意图象B、E中前后两部分的比例关系.

①HNO3 ②CO2 ③糖类 ④CH4 ⑤SO2.
| A. | ①②③④⑤ | B. | ②③⑤ | C. | ②③④ | D. | ② |

部分物质的相关性质如下:
| 熔点/℃ | 沸点/℃ | 备注 | |
| 白磷 | 44 | 280.5 | |
| PH3 | -133.8 | -87.8 | 难溶于水,有还原性 |
| SiF4 | -90 | -86 | 易水解 |
(1)世界上磷矿石最主要的用途是生产含磷肥料,约占磷矿石使用量的69%.
(2)以磷灰石为原料,湿法磷酸过程中Ca5F(PO4)3反应的化学方程式为Ca5F(PO4)3+5H2SO4=5CaSO4+HF↑+3H3PO4.现有1t折合含有P2O5约30%的磷灰石,最多可制得85%的商品磷酸0.49t.
(3)如图(b)所示,热法磷酸生产过程的第一步是将SiO2、过量焦炭与磷灰石混合,高温反应生成白磷.炉渣的主要成分是CaSiO3(填化学式).冷凝塔1的主要沉积物是液态白磷,冷凝塔2的主要沉积物是固态白磷.
(4)尾气中主要含有SiF4、CO,还含有少量的PH3、H2S和HF等.将尾气先通入纯碱溶液,可除去SiF4、H2S、HF;再通入次氯酸钠溶液,可除去PH3.(均填化学式)
(5)相比于湿法磷酸,热法磷酸工艺复杂,能耗高,但优点是产品纯度高.
| A. | 溶解,过滤 | B. | 溶解,蒸发浓缩,冷却结晶,过滤 | ||
| C. | 溶解,蒸发结晶 | D. | 溶解,萃取,分液 |
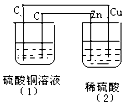 如图的装置中,溶液的体积均为200mL,开始时电解质溶液的浓度均为0.1mol/L,工作一段时间后,测得导线上通过了0.02mole-.若不考虑溶液体积的变化,下列叙述正确的( )
如图的装置中,溶液的体积均为200mL,开始时电解质溶液的浓度均为0.1mol/L,工作一段时间后,测得导线上通过了0.02mole-.若不考虑溶液体积的变化,下列叙述正确的( )| A. | 相同条件下,两容器产生的气体体积相同 | |
| B. | (1)、(2)溶液的pH值均减小 | |
| C. | (1)中阳极电极反应方程式为:4OH--4e-═2H2O+O2↑ | |
| D. | (2)中正极反应为Zn-2e-═Zn2+ |
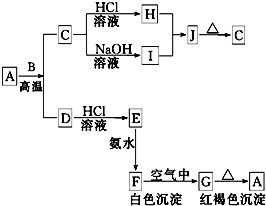 A是一种红棕色金属氧化物,B、D是金属单质,J是一种难溶于水的白色化合物,受热后容易发生分解.
A是一种红棕色金属氧化物,B、D是金属单质,J是一种难溶于水的白色化合物,受热后容易发生分解.
 CH3COOCH2CH3+H2O.
CH3COOCH2CH3+H2O.