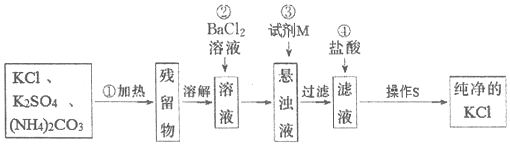
题目内容
2.按要求写出下列反应的离子方程式①人体胃液中有胃酸(0.2%~0.4%的盐酸),起杀菌、帮助消化等作用,但胃酸的量不能过多或过少,它必须控制在一定范围内,当胃酸过多时,医生通常用胃舒平【氢氧化铝】给病人治疗.该反应的离子方程式为Al(OH)3+3H+=Al3++3H2O
②实验室用碳酸钙与盐酸反应制取CO2气体,反应的离子方程式CaCO3+2H+=Ca2++H2O+CO2↑
常用澄清石灰水检验CO2气体的离子方程式是Ca2++2OH-+CO2=CaCO3↓+H2O
③表面附有铁锈(成分是Fe2O3)的铁钉放入稀硫酸中,开始反应的离子方程式是Fe2O3+6H+=2Fe3++3H2O
反应片刻后,可观察到有气体产生,其离子方程式是Fe+2H+=Fe2++H2↑.
分析 ①氢氧化铝与盐酸反应生成氯化铝和水;
②碳酸钙与盐酸反应生成氯化钙、二氧化碳和水;澄清石灰水通入少量二氧化碳反应生成碳酸钙和水;
③氧化铁与稀硫酸反应生成硫酸铁和水;铁与稀硫酸反应生成硫酸亚铁和氢气.
解答 解:①氢氧化铝与盐酸反应生成氯化铝和水,离子方程式:Al(OH)3+3H+=Al3++3H2O;
故答案为:Al(OH)3+3H+=Al3++3H2O;
②碳酸钙与盐酸反应生成氯化钙、二氧化碳和水,离子方程式:CaCO3+2H+=Ca2++H2O+CO2↑; 澄清石灰水通入少量二氧化碳反应生成碳酸钙和水,离子方程式:Ca2++2OH-+CO2=CaCO3↓+H2O;
故答案为:CaCO3+2H+=Ca2++H2O+CO2↑; Ca2++2OH-+CO2=CaCO3↓+H2O;
③表面附有铁锈(成分是Fe2O3)的铁钉放入稀硫酸中,开始氧化铁与稀硫酸反应生成硫酸铁和水,离子方程式是:Fe2O3+6H+=2Fe3++3H2O
反应片刻后,可观察到有气体产生,铁与稀硫酸反应生成硫酸亚铁和氢气,离子方程式是:Fe+2H+=Fe2++H2↑;
故答案为:Fe2O3+6H+=2Fe3++3H2O;Fe+2H+=Fe2++H2↑.
点评 本题考查了离子方程式的书写,明确物质的性质及发生反应的实质是解题关键,题目难度不大.

练习册系列答案
 单元期中期末卷系列答案
单元期中期末卷系列答案
相关题目
13.下面六个图中,横坐标为某溶液中加入某物质的量,纵坐标为生成沉淀的量.从A-F中选择符合表中各题要求的序号填入表中:
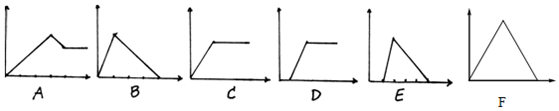

| 溶 液 | 加入的物质 | 答案序号 |
| (1)饱和石灰水 | CO2 | |
| (2)AlCl3溶液 | 过量NH3 | |
| (3)含少量NaOH的NaAlO2 | 过量CO2 | |
| (4)含少量NaOH的NaAlO2 | 逐滴加稀盐酸 | |
| (5)MgCl2、AlCl3混合液 | 逐滴加NaOH至过量 | |
| (6)NaOH溶液 | 逐滴加AlCl3至过量 |
17. 某实验小组用如图装置制备家用消毒液,并探究其性质.反应停止后,取洗气瓶中无色溶液5mL,分别进行了如下实验:
某实验小组用如图装置制备家用消毒液,并探究其性质.反应停止后,取洗气瓶中无色溶液5mL,分别进行了如下实验:
(1)写出利用上述装置制备消毒液涉及反应的化学方程式4HCl+MnO2$\frac{\underline{\;\;△\;\;}}{\;}$Cl2↑+MnCl2+2H2O、Cl2+2NaOH═NaClO+NaCl+H2O.
(2)查阅资料:酚酞的变色范围为8.2~10,且酚酞在强碱性溶液中红色会褪去,为探究操作a中溶液褪色的原因,又补充了如下实验:
获得结论:此实验小组制备的消毒液具有漂白性.
(3)该小组由操作b获得结论:随着溶液酸性的增强,此消毒液的稳定性下降.操作b中溶液变成黄绿色的原因:2H++ClO-+Cl-═Cl2↑+H2O(用离子方程式表示).
(4)有效氯的含量是检测含氯消毒剂消毒效果的重要指标.具体用“单位质量的含氯消毒液在酸性条件下所能释放出氯气的质量”进行表征.一般家用消毒液有效氯含量在5%以上.小组同学进行如下实验测定有效氯:取此消毒液5g,加入20mL 0.5mol•L-1KI溶液,10mL 2mol•L-1的硫酸溶液;加几滴淀粉溶液后.用0.1mol•L-1 Na2S2O3溶液滴定生成的I2,达滴定终点时消耗Na2S2O3 20mL.(已知:2S2O32-+I2═S4O62-+2I-)
①达到滴定终点时的实验现象是溶液蓝色褪去且半分钟恢复.
②此消毒液有效氯含量为1.42%.(保留一位有效数字);
获得结论:此实验制得的消毒液不符合(填“符合”或“不符合”)家用要求.
 某实验小组用如图装置制备家用消毒液,并探究其性质.反应停止后,取洗气瓶中无色溶液5mL,分别进行了如下实验:
某实验小组用如图装置制备家用消毒液,并探究其性质.反应停止后,取洗气瓶中无色溶液5mL,分别进行了如下实验:| 操作 | 现象 |
| a.测溶液pH,并向其中滴加2滴酚酞 | pH=3,溶液变红,5min后褪色 |
| b.向其中逐滴加入盐酸 | 溶液逐渐变成黄绿色 |
(2)查阅资料:酚酞的变色范围为8.2~10,且酚酞在强碱性溶液中红色会褪去,为探究操作a中溶液褪色的原因,又补充了如下实验:
| 操作 | 现象 |
| 取5mLpH=13NaOH溶液,向其中滴加2滴酚酞 | 溶液变红,30min后褪色 |
(3)该小组由操作b获得结论:随着溶液酸性的增强,此消毒液的稳定性下降.操作b中溶液变成黄绿色的原因:2H++ClO-+Cl-═Cl2↑+H2O(用离子方程式表示).
(4)有效氯的含量是检测含氯消毒剂消毒效果的重要指标.具体用“单位质量的含氯消毒液在酸性条件下所能释放出氯气的质量”进行表征.一般家用消毒液有效氯含量在5%以上.小组同学进行如下实验测定有效氯:取此消毒液5g,加入20mL 0.5mol•L-1KI溶液,10mL 2mol•L-1的硫酸溶液;加几滴淀粉溶液后.用0.1mol•L-1 Na2S2O3溶液滴定生成的I2,达滴定终点时消耗Na2S2O3 20mL.(已知:2S2O32-+I2═S4O62-+2I-)
①达到滴定终点时的实验现象是溶液蓝色褪去且半分钟恢复.
②此消毒液有效氯含量为1.42%.(保留一位有效数字);
获得结论:此实验制得的消毒液不符合(填“符合”或“不符合”)家用要求.
3.实验室中用苯甲醛制备苯甲醇和苯甲酸,已知反应原理为
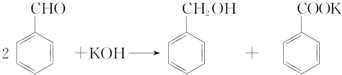
部分试剂的物理常数如下表所示:
制备苯甲醇和苯甲酸的主要过程如下:
在锥形瓶中,加13.5g KOH、13.5mL H2O,在不断振荡下分批加入新制的苯甲醛,共加入15mL新制的苯甲醛,塞紧瓶口,用力振摇得到白色糊状物,放置24h以上.
向锥形瓶中加入大约45mL水,使反应混合物中的苯甲酸盐溶解,转移至分液漏斗中,用45mL乙醚分三次萃取苯甲醇,合并乙醚萃取液.保存水溶液留用.
依次用15mL 25%的亚硫酸氢钠溶液及8mL水洗涤乙醚萃取液,再加入少量无水硫酸镁静置片刻,过滤除去MgSO4固体.把乙醚萃取液倒入圆底烧瓶,加入2小片碎瓷片,先水浴蒸馏,再用酒精灯加热蒸馏,收集产品可得苯甲醇(装置如图1所示).
制取纯净苯甲酸的过程略.
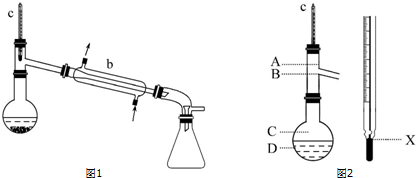
试完成下列问题:
(1)仪器b的名称为冷凝管.
(2)混合苯甲醛、氢氧化钾和水应选用的锥形瓶要用胶塞塞住,其原因是防止苯甲醛被空气中的氧气氧化.
(3)若将苯甲醛一次性倒入锥形瓶,可能导致A、D.
A.反应太剧烈B.液体太多无法振荡C.反应变缓慢D.产率降低
(4)分液漏斗使用前须检查是否漏水(或检漏)并洗净备用.
(5)制取苯甲醇时,用25%亚硫酸氢钠溶液洗涤是为了除去未反应的苯甲醛.实验中加入少量无水MgSO4的目的是干燥乙醚萃取液.
(6)在使用图2所示仪器的操作中,温度计水银球的上沿X的放置位置为B(填图示“A”“B”“C”或“D”).
(7)蒸馏过程中水浴加热蒸出的主要为乙醚,然后加热收集沸点204~206℃的馏分得到苯甲醇.某同学一次实验中发现温度在178~180℃时有少量液体蒸出,则该馏分可能为苯甲醛.

部分试剂的物理常数如下表所示:
| 名称 | 性状 | 熔点/℃ | 沸点/℃ | 密度/g•cm-3 | 水溶性 |
| 苯甲醛 | 无色液体,苦杏仁味 | -26 | 178.1 | 1.041 5 | 微溶 |
| 苯甲酸 | 白色片状或针状晶体 | 122.4 | 248 | 1.265 9 | 微溶 |
| 苯甲醇 | 无色液体,有芳香味 | -15.3 | 205.35 | 1.041 9 | 微溶 |
| 乙醚 | 无色透明液体, 有特殊刺激性气味 | -116.3 | 34.6 | 0.71 | 不溶 |
在锥形瓶中,加13.5g KOH、13.5mL H2O,在不断振荡下分批加入新制的苯甲醛,共加入15mL新制的苯甲醛,塞紧瓶口,用力振摇得到白色糊状物,放置24h以上.
向锥形瓶中加入大约45mL水,使反应混合物中的苯甲酸盐溶解,转移至分液漏斗中,用45mL乙醚分三次萃取苯甲醇,合并乙醚萃取液.保存水溶液留用.
依次用15mL 25%的亚硫酸氢钠溶液及8mL水洗涤乙醚萃取液,再加入少量无水硫酸镁静置片刻,过滤除去MgSO4固体.把乙醚萃取液倒入圆底烧瓶,加入2小片碎瓷片,先水浴蒸馏,再用酒精灯加热蒸馏,收集产品可得苯甲醇(装置如图1所示).
制取纯净苯甲酸的过程略.

试完成下列问题:
(1)仪器b的名称为冷凝管.
(2)混合苯甲醛、氢氧化钾和水应选用的锥形瓶要用胶塞塞住,其原因是防止苯甲醛被空气中的氧气氧化.
(3)若将苯甲醛一次性倒入锥形瓶,可能导致A、D.
A.反应太剧烈B.液体太多无法振荡C.反应变缓慢D.产率降低
(4)分液漏斗使用前须检查是否漏水(或检漏)并洗净备用.
(5)制取苯甲醇时,用25%亚硫酸氢钠溶液洗涤是为了除去未反应的苯甲醛.实验中加入少量无水MgSO4的目的是干燥乙醚萃取液.
(6)在使用图2所示仪器的操作中,温度计水银球的上沿X的放置位置为B(填图示“A”“B”“C”或“D”).
(7)蒸馏过程中水浴加热蒸出的主要为乙醚,然后加热收集沸点204~206℃的馏分得到苯甲醇.某同学一次实验中发现温度在178~180℃时有少量液体蒸出,则该馏分可能为苯甲醛.
 在0.2L由NaCl、MgCl2、CaCl2组成的混合液中,部分离子浓度大小如图所示,回答下列问题:
在0.2L由NaCl、MgCl2、CaCl2组成的混合液中,部分离子浓度大小如图所示,回答下列问题: