题目内容
12. 雾霾天气的频繁出现严重影响了我国居民的生活健康.研究显示其中首要污染物为可吸入颗粒物PM2.5,燃煤、机动车和扬尘是造成污染的主要原因.因此,运用化学法防治大气污染是当下重要的研究方向.
雾霾天气的频繁出现严重影响了我国居民的生活健康.研究显示其中首要污染物为可吸入颗粒物PM2.5,燃煤、机动车和扬尘是造成污染的主要原因.因此,运用化学法防治大气污染是当下重要的研究方向.(1)汽车尾气中含有CO、NO等多种污染物.
①在汽车排气管上装一个催化转化装置可将CO与NO转化成参与大气循环的无毒物质.反应的化学方程式是2NO+2CO$\frac{\underline{\;催化剂\;}}{\;}$N2+2CO2.
②气缸中生成NO的反应原理为:N2(g)+O2(g)?2NO(g)△H>0.若1mol空气中的N2(体积分数为80%)和O2(体积分数为20%)在一定温度下于密闭容器内反应,达到平衡时测得NO为6×10-4mol,则此温度下该反应的平衡常数K=2.25×10-6,汽车行驶时,气缸温度越高,单位时间内排放的NO越多,原因是温度升高,反应速率加快,正反应为放热反应,温度升高,有利于平衡反应正向进行.
(2)煤的气化是获得洁净燃料、降低SO2排放的重要途径之一.已知:
2H2(g)+O2(g)=2H2O(g)△H=-483.6kJ•mol-1,
C(s)+$\frac{1}{2}$O2(g)=CO(g)△H=-110.5kJ•mol-1.
写出焦炭与水蒸气反应生成水煤气的热化学方程式:C(s)+H2O(g)=CO(g)+H2(g)△H=+1341.3kJ/mol.
(3)CO与H2反应可制备甲醇.某实验室组装的CH3OH-O2燃料电池的工作原理如图所示.
①该电池工作时,b口通入的物质为CH3OH.
②该电池负极的电极反应式为CH3OH+H2O-6e-=CO2+6H+.
③若用该燃料电池电解精炼铜,当析出精铜32g时,理论上该电池消耗的O2在标准状况下的体积为5.6L.
(4)常温下将PM2.5的空气样本用蒸馏水处理,制成待测试样.测得该试样所含水溶性离子的化学组分及平均浓度如下表所示.
| 离子 | Na+ | K+ | NH4+ | NO3- | SO42- | Cl- |
| 浓度/mol•L-1 | 7×10-6 | 3×10-6 | 2×10-5 | 5×10-5 | 3×10-5 | 2×10-5 |
分析 (1)①CO与NO转化成参与大气循环的无毒物质,反应生成氮气与二氧化碳;
②根据平衡时NO的物质的量,结合方程式计算平衡时各组分物质的量,反应前后气体分子数目不变,用物质的量代替浓度代入K=$\frac{{c}^{2}(NO)}{c({N}_{2})×c({O}_{2})}$计算;
温度升高,反应速率加快;温度升高,有利于平衡反应正向进行;
(2)已知:①.2H2(g)+O2(g)=2H2O(g)△H=-483.6kJ•mol-1,
②.C(s)+$\frac{1}{2}$O2(g)=CO(g)△H=-110.5kJ•mol-1.
根据盖斯定律,②-①×$\frac{1}{2}$可得:C(s)+H2O(g)=CO(g)+H2(g);
(3)①由质子移动方向可知,左室为负极,右室为正极,负极发生氧化反应,正极发生还原反应,则甲醇在负极加入,氧气在正极通入;
②甲醇在负极失去电子,生成二氧化碳与氢离子;
③根据电子转移守恒计算氧气物质的量,再根据V=nVm计算氧气体积;
(4)根据电荷守恒判断溶液酸碱性,利用电荷守恒计算溶液中H+离子浓度,若为碱性,忽略氢离子,若为酸性,忽略氢氧根离子,再根据pH=-lgc(H+)计算.
解答 解:(1)①CO与NO转化成参与大气循环的无毒物质,反应生成氮气与二氧化碳,反应方程式为:2NO+2CO$\frac{\underline{\;催化剂\;}}{\;}$N2+2CO2,
故答案为:2NO+2CO$\frac{\underline{\;催化剂\;}}{\;}$N2+2CO2;
②1mol空气中的N2为0.8mol、O2为0.2mol,达到平衡时测得NO为6×10-4 mol,则:
N2(g)+O2(g)?2NO(g)
起始量(mol):0.8 0.2 0
变化量(mol):3×10-4 3×10-4 6×10-4
平衡量(mol):7997×10-4 1997×10-4 6×10-4
反应前后气体分子数目不变,可以用物质的量代替浓度计算平衡常数,故平衡常数K=$\frac{{c}^{2}(NO)}{c({N}_{2})×c({O}_{2})}$=$\frac{(6×1{0}^{-4})^{2}}{7997×1{0}^{-4}×1997×1{0}^{-4}}$=2.25×10-6,
温度升高,反应速率加快,正反应为放热反应,温度升高,有利于平衡反应正向进行,气缸温度越高,单位时间内排放的NO越多,
故答案为:2.25×10-6;温度升高,反应速率加快,正反应为放热反应,温度升高,有利于平衡反应正向进行;
(2)已知:①.2H2(g)+O2(g)=2H2O(g)△H=-483.6kJ•mol-1,
②.C(s)+$\frac{1}{2}$O2(g)=CO(g)△H=-110.5kJ•mol-1.
根据盖斯定律,②-①×$\frac{1}{2}$可得:C(s)+H2O(g)=CO(g)+H2(g)△H=+1341.3kJ/mol,
故答案为:C(s)+H2O(g)=CO(g)+H2(g)△H=+1341.3kJ/mol;
故答案为:温度升高,反应速率加快;温度升高,有利于平衡反应正向进行;
(3)①由质子移动方向可知,左室为负极,右室为正极,负极发生氧化反应,正极发生还原反应,则甲醇在负极加入,氧气在正极通入,则b口通入的物质为CH3OH,生成的二氧化碳在a口排出,
故答案为:CH3OH;
②甲醇在负极失去电子,生成二氧化碳与氢离子,负极电极反应式为CH3OH+H2O-6e-=CO2+6H+,
故答案为:CH3OH+H2O-6e-=CO2+6H+;
③析出精铜32g时,Cu的物质的量为$\frac{32g}{64g/mol}$=0.5mol,根据电子转移守恒,消耗氧气物质的量为$\frac{0.5mol×2}{4}$=0.25mol,消耗氧气体积为0.25mol×22.4L/mol=5.6L,
故答案为:5.6;
(4)由电荷守恒可知,c(K+)+c(Na+)+c(H+)+c(NH4+)=c(OH-)+c(Cl-)+2c(SO42-)+c(NO3-),则c(H+)-c(OH-)=(2×10-5 +2×3×10-5 +5×10-5-3×10-6-7×10-6-2×10-5 )mol/L=10-4mol/L,溶液呈酸性,溶液中H+离子浓度约是为10-4,pH值=-lgc(H+)=4,
故答案为:4.
点评 本题考查化学平衡计算、热化学方程式书写、原电池、溶液酸碱性判断与pH计算、化学反应速率与化学平衡影响因素等,属于拼合型题目,需要学生具备扎实的基础,难度中等.

 阅读快车系列答案
阅读快车系列答案| A. | 3种 | B. | 5种 | C. | 6种 | D. | 8种 |

(1)酸溶过程中Fe2O3与稀硫酸反应的化学方程式为Fe2O3+3H2SO4═Fe2(SO4)3+3H2O;
“滤渣A”主要成份的化学式为SiO2.
(2)还原过程中加入FeS2的目的是将溶液中的Fe3+还原为Fe2+,而本身被氧化为H2SO4,请完成该反应的离子方程式:FeS2+14Fe3++8H2O═15Fe2++2SO42-+16H+.
(3)氧化过程中,O2、NaOH与Fe2+反应的离子方程式为4Fe2++O2+2H2O+8OH-=4Fe(OH)3↓(或Fe2++2OH-=Fe(OH)2↓,4Fe(OH)2+O2+2H2O=4Fe(OH)3).
(4)为了确保铁红的质量,氧化过程需要调节溶液的pH的范围是3.2~3.8(或之间的数据值)(几种离子沉淀的pH见下表);滤液B可以回收的物质有(写化学式)Na2SO4、Al2(SO4)3、MgSO4.
| 沉淀物 | Fe(OH)3 | Al(OH)3 | Fe(OH)2 | Mg(OH)2 |
| 开始沉淀pH | 2.7 | 3.8 | 7.6 | 9.4 |
| 完全沉淀pH | 3.2 | 5.2 | 9.7 | 12.4 |
| A. | 碳酸氢钠溶液与少量澄清石灰水反应:HCO3-+Ca2++OH-═CaCO3↓+H2O | |
| B. | 向沸水中滴加FeCl3溶液制备Fe(OH)3胶体:Fe3++3H2O═Fe(OH)3↓+3H+ | |
| C. | 金属铝溶于氢氧化钠溶液:Al+2OH-═AlO2-+H2↑ | |
| D. | 铁跟氯化铁溶液反应:Fe+2Fe3+═3Fe2+ |
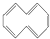 ,下列说法正确的是( )
,下列说法正确的是( )| A. | 根据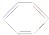 的结构特点可知环癸五烯的分子式为C10H8 的结构特点可知环癸五烯的分子式为C10H8 | |
| B. | 常温常压下环癸五烯是一种易溶于水的无色气体 | |
| C. | 环癸五烯既能使溴水褪色,又能使酸性KMnO4溶液褪色 | |
| D. | 环癸五烯与Cl2的加成产物只有一种 |
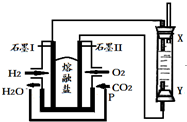 以H2、O2、熔融盐Na2CO3组成燃料电池,采用电解法制备Fe(OH)2,装置如图所示,其中P端通入CO2.
以H2、O2、熔融盐Na2CO3组成燃料电池,采用电解法制备Fe(OH)2,装置如图所示,其中P端通入CO2.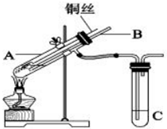 (1)用铜与浓硫酸反应制取硫酸铜,实验装置如图所示.
(1)用铜与浓硫酸反应制取硫酸铜,实验装置如图所示.