题目内容
16.分子式为C8H10的某有机物,它能使酸性高锰酸钾溶液褪色,但不能与溴水反应,在一定条件下与H2完全加成后,所得产物的一氯代物的同分异构体(不包括立体异构)数目不可能为( )| A. | 3种 | B. | 5种 | C. | 6种 | D. | 8种 |
分析 分子式为C8H10的某有机物,它能使酸性高锰酸钾溶液褪色,但不能与溴水反应,说明含有苯环,结合C、H原子数目关系可知,属于苯的同系物,故侧链为烷基,若有1个侧链,为-CH2-CH3;若有2个侧链,为-CH3,有邻、间、对三种,该化合物在一定条件下与H2完全加成,加成后产物分子中有几种等效氢原子,就有几种一氯代物,据此进行解答.
解答 解:分子式为C8H10的某有机物,它能使酸性高锰酸钾溶液褪色,但不能与溴水反应,说明含有苯环,结合C、H原子数目关系可知,属于苯的同系物,故侧链为烷基,
①若有1个侧链,为-CH2-CH3,结构简式为: ,该化合物在一定条件下与H2完全加成,加成后产物分子中有6种等效氢原子,一氯代物有6种;
,该化合物在一定条件下与H2完全加成,加成后产物分子中有6种等效氢原子,一氯代物有6种;
若有2个侧链,为-CH3,有邻、间、对三种,
②两个甲基处于邻位时,其结构简式为: ,该化合物在一定条件下与H2完全加成,加成后产物分子中有4种等效氢原子,一氯代物有4种;
,该化合物在一定条件下与H2完全加成,加成后产物分子中有4种等效氢原子,一氯代物有4种;
③两个甲基处于间位时,结构简式为: ,该化合物在一定条件下与H2完全加成,加成后产物分子中有5种等效氢原子,一氯代物有5种;
,该化合物在一定条件下与H2完全加成,加成后产物分子中有5种等效氢原子,一氯代物有5种;
④两个甲基处于对位时,结构简式为: ,该化合物在一定条件下与H2完全加成,加成后产物分子中有3种等效氢原子,一氯代物有3种;
,该化合物在一定条件下与H2完全加成,加成后产物分子中有3种等效氢原子,一氯代物有3种;
根据分析可知,所得产物的一氯代物的同分异构体(不包括立体异构)数目可能为3、4、5、6种,不可能为8种,
故选D.
点评 本题考查了同分异构体的书写、有机物的性质等知识,题目难度不大,判断侧链、等效氢的判断是解题的关键,试题培养了学生的逻辑推理能力.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
6.下列说法正确的是( )
| A. | 将废电池深埋,可防止重金属污染 | |
| B. | 所有需要加热的化学反应都是吸热反应 | |
| C. | 开发太阳能、风能和氢能等能源代替化石燃料,有利于节约资源、保护环境 | |
| D. | 开发利用可燃冰是缓解能源紧缺的唯一途径 |
4.离子晶体中一定不会存在的相互作用是( )
| A. | 离子键 | B. | 极性键 | C. | 非极性键 | D. | 范德华力 |
12. 雾霾天气的频繁出现严重影响了我国居民的生活健康.研究显示其中首要污染物为可吸入颗粒物PM2.5,燃煤、机动车和扬尘是造成污染的主要原因.因此,运用化学法防治大气污染是当下重要的研究方向.
雾霾天气的频繁出现严重影响了我国居民的生活健康.研究显示其中首要污染物为可吸入颗粒物PM2.5,燃煤、机动车和扬尘是造成污染的主要原因.因此,运用化学法防治大气污染是当下重要的研究方向.
(1)汽车尾气中含有CO、NO等多种污染物.
①在汽车排气管上装一个催化转化装置可将CO与NO转化成参与大气循环的无毒物质.反应的化学方程式是2NO+2CO$\frac{\underline{\;催化剂\;}}{\;}$N2+2CO2.
②气缸中生成NO的反应原理为:N2(g)+O2(g)?2NO(g)△H>0.若1mol空气中的N2(体积分数为80%)和O2(体积分数为20%)在一定温度下于密闭容器内反应,达到平衡时测得NO为6×10-4mol,则此温度下该反应的平衡常数K=2.25×10-6,汽车行驶时,气缸温度越高,单位时间内排放的NO越多,原因是温度升高,反应速率加快,正反应为放热反应,温度升高,有利于平衡反应正向进行.
(2)煤的气化是获得洁净燃料、降低SO2排放的重要途径之一.已知:
2H2(g)+O2(g)=2H2O(g)△H=-483.6kJ•mol-1,
C(s)+$\frac{1}{2}$O2(g)=CO(g)△H=-110.5kJ•mol-1.
写出焦炭与水蒸气反应生成水煤气的热化学方程式:C(s)+H2O(g)=CO(g)+H2(g)△H=+1341.3kJ/mol.
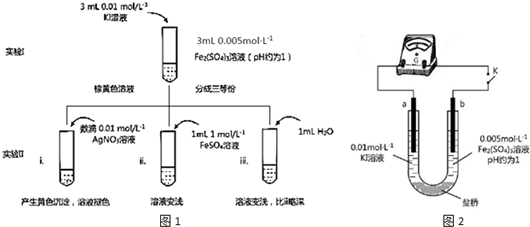
(3)CO与H2反应可制备甲醇.某实验室组装的CH3OH-O2燃料电池的工作原理如图所示.
①该电池工作时,b口通入的物质为CH3OH.
②该电池负极的电极反应式为CH3OH+H2O-6e-=CO2+6H+.
③若用该燃料电池电解精炼铜,当析出精铜32g时,理论上该电池消耗的O2在标准状况下的体积为5.6L.
(4)常温下将PM2.5的空气样本用蒸馏水处理,制成待测试样.测得该试样所含水溶性离子的化学组分及平均浓度如下表所示.
则根据表中数据可计算出该待测试样的pH=4.
 雾霾天气的频繁出现严重影响了我国居民的生活健康.研究显示其中首要污染物为可吸入颗粒物PM2.5,燃煤、机动车和扬尘是造成污染的主要原因.因此,运用化学法防治大气污染是当下重要的研究方向.
雾霾天气的频繁出现严重影响了我国居民的生活健康.研究显示其中首要污染物为可吸入颗粒物PM2.5,燃煤、机动车和扬尘是造成污染的主要原因.因此,运用化学法防治大气污染是当下重要的研究方向.(1)汽车尾气中含有CO、NO等多种污染物.
①在汽车排气管上装一个催化转化装置可将CO与NO转化成参与大气循环的无毒物质.反应的化学方程式是2NO+2CO$\frac{\underline{\;催化剂\;}}{\;}$N2+2CO2.
②气缸中生成NO的反应原理为:N2(g)+O2(g)?2NO(g)△H>0.若1mol空气中的N2(体积分数为80%)和O2(体积分数为20%)在一定温度下于密闭容器内反应,达到平衡时测得NO为6×10-4mol,则此温度下该反应的平衡常数K=2.25×10-6,汽车行驶时,气缸温度越高,单位时间内排放的NO越多,原因是温度升高,反应速率加快,正反应为放热反应,温度升高,有利于平衡反应正向进行.
(2)煤的气化是获得洁净燃料、降低SO2排放的重要途径之一.已知:
2H2(g)+O2(g)=2H2O(g)△H=-483.6kJ•mol-1,
C(s)+$\frac{1}{2}$O2(g)=CO(g)△H=-110.5kJ•mol-1.
写出焦炭与水蒸气反应生成水煤气的热化学方程式:C(s)+H2O(g)=CO(g)+H2(g)△H=+1341.3kJ/mol.
(3)CO与H2反应可制备甲醇.某实验室组装的CH3OH-O2燃料电池的工作原理如图所示.
①该电池工作时,b口通入的物质为CH3OH.
②该电池负极的电极反应式为CH3OH+H2O-6e-=CO2+6H+.
③若用该燃料电池电解精炼铜,当析出精铜32g时,理论上该电池消耗的O2在标准状况下的体积为5.6L.
(4)常温下将PM2.5的空气样本用蒸馏水处理,制成待测试样.测得该试样所含水溶性离子的化学组分及平均浓度如下表所示.
| 离子 | Na+ | K+ | NH4+ | NO3- | SO42- | Cl- |
| 浓度/mol•L-1 | 7×10-6 | 3×10-6 | 2×10-5 | 5×10-5 | 3×10-5 | 2×10-5 |
9.下列离子方程式正确的是( )
| A. | Si投入NaOH溶液中 Si+2OH-═SiO32-+H2 | |
| B. | 把 Al中投入到少量氢氧化钠溶液 Al3++3OH-═Al(OH)3↓ | |
| C. | 向明矾溶液中加入氢氧化钡溶液,恰好使“SO42-”完全沉淀 Al3++2SO42-+2Ba2++3OH-═2BaSO4↓+Al(OH)3↓ | |
| D. | Na[Al(OH)4]溶液中加入过量CO2[Al(OH)4]-+CO2═HCO3-+Al(OH)3↓ |
10.下列有关化学与生活、工业的叙述中,不正确的是( )
| A. | 工业上生产玻璃、水泥、漂白粉及用铁矿石冶炼铁,均需要用石灰石为原料 | |
| B. | 面粉中禁止添加CaO2、过氧化苯甲酰等增白剂,CaO2属于碱性氧化物,过氧化苯甲酰属于有机物 | |
| C. | 未成熟的苹果肉遇碘酒变蓝色,成熟苹果的汁液能与银氨溶液发生反应 | |
| D. | 大力实施矿物燃料“脱硫、脱硝技术”,可以减少硫的氧化物和氮的氧化物对环境的污染 |
 .
.