题目内容
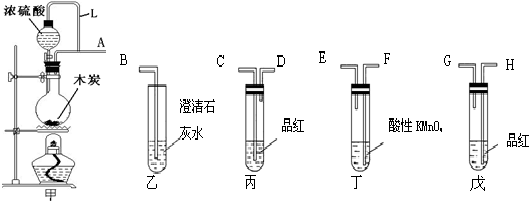
8.根据如图所示实验回答下列问题: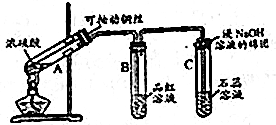
(1)试管A中发生反应的化学方程式Cu+H2SO4$\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+SO2↑+H2O.
(2)试管B中的实验现象是品红溶液褪色;若对该试管中反应后的溶液加热,可以观察到试管B中的实验现象是溶液恢复颜色.
(3)试管C中的实验现象是石蕊试液变红.
(4)试管C口部棉团的作用是吸收二氧化硫,其反应的离子方程式是SO2+2OH-=SO32-+H2O.
分析 (1)金属铜可以和浓硫酸之间反应生成硫酸铜、水以及二氧化硫;
(2)二氧化硫具有漂白性,能使品红褪色,加热,溶液恢复颜色;
(3)二氧化硫是酸性气体,能使紫色的石蕊试液变为红色;
(4)二氧化硫有毒,是酸性气体,可以和强碱氢氧化钠溶液反应,据此回答.
解答 解:(1)金属铜可以和浓硫酸之间反应生成硫酸铜、水以及二氧化硫,反应为:Cu+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+SO2↑+2H2O,故答案为:Cu+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+SO2↑+2H2O;
(2)二氧化硫具有漂白性,能使品红褪色,所以试管B中的实验现象是品红溶液褪色,对该试管中反应后的溶液加热,溶液恢复颜色,故答案为:品红溶液褪色;溶液恢复颜色;
(3)二氧化硫是酸性气体,能使紫色的石蕊试液变为红色,故答案为:石蕊试液变红;
(4)二氧化硫有毒,是酸性气体,为防止污染可以用强碱氢氧化钠溶液来吸收,发生反应为:SO2+2OH-=SO32-+H2O,故答案为:吸收二氧化硫;SO2+2OH-=SO32-+H2O.
点评 本题考查了浓硫酸性质的分析判断,产物的实验设计和实验验证方法、试剂选择、反应现象的判断,题目难度中等.

练习册系列答案
相关题目
4.将下列各组物质按单质、酸、碱、盐分类顺序排列,其中正确的是( )
| A. | 氯水、盐酸、火碱、硫酸钡 | B. | 水银、硫酸、烧碱、硫酸氢钠 | ||
| C. | 铜、醋酸、石灰石、氯化铜 | D. | 臭氧、硝酸、纯碱、胆矾 |
2.具备基本的化学实验技能是进行科学探究的基础和保证.下列有关实验操作正确的是( )
| A. |  点燃酒精灯 | B. |  称取氯化钠 | C. |  液体加热 | D. |  量取9.5mL的液体 |
20.Ⅰ、在2L密闭容器内,800℃时发生反应:2NO(g)+O2(g)?2NO2(g),在体系中,n(NO)随时间的变化如表:
(1)上述反应在第5s时,NO的转化率为65%.
(2)用O2表示从0~2 s内该反应的平均速率v(O2)=0.00125mol/(L•s).
(3)能说明该反应已达到平衡状态的是bc.
a.v(NO2)=2v(O2) b.容器内压强保持不变
c.v逆(NO)=2v正(O2) d.容器内气体密度保持不变
Ⅱ、下表中的数据是破坏1mol物质中的化学键所消耗的能量:
根据上述数据回答下列问题:
(4)下列物质本身具有的能量最低的是A.
A.H2 B.Cl2 C.Br2 D.I2
(5)下列氢化物中最稳定的是A.
A.HCl B.HBr C.HI
(6)X2+H2=2HX(X代表Cl、Br、I)的反应是吸热反应还是放热反应?放热反应.
| 时间(s) | 0 | 1 | 2 | 3 | 4 | 5 |
| NO的物质的量(mol) | 0.020 | 0.010 | 0.008 | 0.007 | 0.007 | 0.007 |
(2)用O2表示从0~2 s内该反应的平均速率v(O2)=0.00125mol/(L•s).
(3)能说明该反应已达到平衡状态的是bc.
a.v(NO2)=2v(O2) b.容器内压强保持不变
c.v逆(NO)=2v正(O2) d.容器内气体密度保持不变
Ⅱ、下表中的数据是破坏1mol物质中的化学键所消耗的能量:
| 物质 | Cl2 | Br2 | I2 | HCl | HBr | HI | H2 |
| 能量(kJ) | 243 | 193 | 151 | 431 | 366 | 298 | 436 |
(4)下列物质本身具有的能量最低的是A.
A.H2 B.Cl2 C.Br2 D.I2
(5)下列氢化物中最稳定的是A.
A.HCl B.HBr C.HI
(6)X2+H2=2HX(X代表Cl、Br、I)的反应是吸热反应还是放热反应?放热反应.
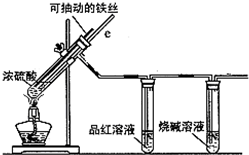 某校化学小组为探究铁与浓硫酸反应是否生成SO2,设计了以下装置进行实验.
某校化学小组为探究铁与浓硫酸反应是否生成SO2,设计了以下装置进行实验.