题目内容
20.下列溶液中Cl-浓度最大的是( )| A. | 1000mL 3mol/L NaCl溶液 | B. | 400mL 2.5mol/L MgCl2溶液 | ||
| C. | 300mL 1mol/L AlCl3溶液 | D. | 200mL1mol/L 盐酸 |
分析 根据溶液中不水解的离子的物质的量浓度=溶质的物质的量浓度×化学式中离子的个数,与溶液的体积无关,据此分析解答.
解答 解:A、1000mL 3mol/L NaCl溶液中氯离子的物质的量浓度=3mol/L×1=3mol/L;
B、400mL 2.5mol/L MgCl2溶液中氯离子的物质的量浓度=2.5mol/L×2=5mol/L;
C、300mL 1mol/L AlCl3溶液中氯离子的物质的量浓度=1mol/L×3=3mol/L;
D、200mL1mol/L 盐酸中氯离子的物质的量浓度=1mol/L×1=1mol/L;
Cl-的浓度最大的是5mol/L,
故选B.
点评 本题考查物质的量浓度的计算与理解,题目难度不大,注意溶液中溶质离子的浓度与溶液体积无关,只取决于物质电离出的离子的数目多少与溶质的浓度.

练习册系列答案
 寒假学与练系列答案
寒假学与练系列答案
相关题目
10.下列物质中含有Cl-的是( )
| A. | 氯水 | B. | 液氯 | C. | 次氯酸钠固体 | D. | 熔融的氯酸钾 |
11.可逆反应①X(g)+2Y(g)?2Z(g)、②2M(g)?N(g)+P(g)分别在密闭容器的两个反应室中进行,反应室之间有无摩擦力、可自由滑动的密封隔板.反应开始和达到平衡状态时有关物理量的变化如图所示:
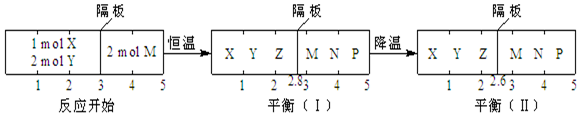
下列判断正确的是( )

下列判断正确的是( )
| A. | 反应①的正反应是吸热反应 | |
| B. | 达平衡(I)时体系的压强与反应开始时体系的压强之比为14:15 | |
| C. | 达平衡(I)时,X的转化率为$\frac{5}{11}$ | |
| D. | 在平衡(I)和平衡(II)中,M在隔板右边气体中的体积分数不变 |
8.酸雨的水溶液的pH值范围是( )
| A. | pH小于7 | B. | pH小于5.6 | C. | pH大于5.6 | D. | pH小于0 |
15.在一定温度下,将气体X与气体Y各0.16mol充入10L恒容密闭容器中,发生反应:X(g)+Y(g)?2Z(g)△H<0,一段时间后达到平衡.反应过程中测定的数据如表:下列说法正确的是( )
| t∕min | 2 | 4 | 7 | 9 |
| n(Y)∕mol | 0.12 | 0.11 | 0.10 | 0.10 |
| A. | 反应前4min的平均反应速率υ(Z)=0.0125 mol•L-1•min-1 | |
| B. | 其他条件不变,降低温度,反应达到新平衡前υ(逆)>υ(正) | |
| C. | 该温度下此反应的平衡常数K=1.44 | |
| D. | 其他条件不变,再充入0.2molZ,达平衡时X的体积分数增大 |
5.下列离子方程式书写正确的是( )
| A. | 三氧化硫溶于水:SO3+H2O=SO42-+2H+ | |
| B. | 氯气溶于水:Cl2+H2O=2H++ClO-+Cl- | |
| C. | 过氧化钠与水反应:2O22-+2H2O=4OH-+O2↑ | |
| D. | 大理石与稀盐酸反应制取二氧化碳:CO32-+2H+=CO2↑+H2O |
12.常温下,NaHCO3溶液呈弱碱性.下列关于0.10mol•L-1NaHCO3溶液的说法正确的是( )
| A. | 加水稀释,HCO3-?H++CO32-平衡右移,溶液中氢离子浓度减小 | |
| B. | 加水稀释后,碳酸氢根离子水解平衡向右移动,溶液中氢氧根离子浓度减小 | |
| C. | 加水稀释后,n(H+)与n(OH-)的乘积不变 | |
| D. | 温度升高,c(HCO3-)增大 |
9.对已经达到衡的下列反应;2X(g)+Y(g)?2Z(g)减小压强时,对反应产生的影响是( )
| A. | 逆反应速率增大,正反应速率减小,平衡向逆反应方向移动 | |
| B. | 逆反应速率减小,正反应速率增大,平衡向正反应方向移动 | |
| C. | 正、逆速率都减小,平衡向逆反应方向移动 | |
| D. | 正、逆速率都增大,平衡向正反应方向移动 |
13.下列叙述中正确的是( )
| A. | 1molO2的质量是32g•mol-1 | |
| B. | SO 42-的摩尔质量为 96 g•mol-1 | |
| C. | 1mol 任何物质的质量等于该物质的相对分子质量 | |
| D. | CO2的摩尔质量是44g |