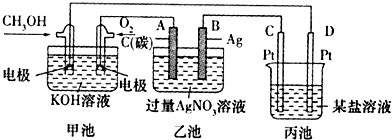
题目内容
12.某同学用浓度为0.1000mol/L的标准盐酸滴定未知浓度的氢氧化钠溶液,试回答下列问题:(1)将标准盐酸装在25.00mL酸式(填“酸式”或“碱式”)滴定管中,调节液面位置在0刻度以下
处,并记下刻度.
(2)用酚酞或甲基橙试剂作指示剂时,判断滴定终点的现象是溶液颜色由浅红色刚好至无色且半分钟内不变色或溶液由黄变橙色且半分钟内不变色时为止.
(3)试分析滴定误差可能由下列哪些实验操作引起的结果偏低ACE.
A、转移待测液至容量瓶时,未洗涤烧杯
B、酸式滴定管用蒸馏水洗涤后,直接装盐酸
C、滴定时,反应容器摇动太激烈,有少量液体溅出
D、滴定到终点时,滴定管尖嘴悬有液滴
E、读数(滴定管)开始时仰视,终点时俯视.
分析 (1)盐酸应用酸式滴定管量取,然后调节液面;
(2)强酸与强碱反应,可用酚酞作指示剂,滴定前,酚酞遇碱变红,滴定后若变无色,停止滴定;可用甲基橙作指示剂,滴定前,甲基橙遇碱变黄,滴定后若变橙色,停止滴定;
(3)根据c(待测)=$\frac{c(标准)×V(标准)}{V(待测)}$,判断不当操作对V(标准)影响,从而判断对浓度的影响.
解答 解:(1)盐酸应用酸式滴定管量取,调节液面位置在0刻度或0刻度下某一刻度;
故答案为:酸式;
(2)强酸与强碱反应,可用酚酞作指示剂,滴定前,酚酞遇碱变红,到达滴定终点时溶液颜色由浅红色变为无色,且半分钟内不变色;可用甲基橙作指示剂,滴定前,甲基橙遇碱变黄,到达滴定终点时溶液由黄变橙色,且半分钟内不变色;
故答案为:酚酞或甲基橙,溶液颜色由浅红色刚好至无色且半分钟内不变色或溶液由黄变橙色且半分钟内不变色;
(3)A.转移待测液至容量瓶时,未洗涤烧杯,NaOH的物质的量减少,造成V(标准)偏小,根据c(待测)=$\frac{c(标准)×V(标准)}{V(待测)}$分析,结果偏小,故A正确;
B.酸式滴定管用蒸馏水洗涤后,直接装盐酸,盐酸的浓度偏低,造成V(标准)偏大,根据c(待测)=$\frac{c(标准)×V(标准)}{V(待测)}$分析,结果偏大,故B错误;
C.滴定时,反应容器摇动太激烈,有少量液体溅出,NaOH的物质的量减少,造成V(标准)偏小,根据c(待测)=$\frac{c(标准)×V(标准)}{V(待测)}$分析,结果偏小,故C正确;
D.滴定到终点时,滴定管尖嘴悬有液滴,造成V(标准)偏大,根据c(待测)=$\frac{c(标准)×V(标准)}{V(待测)}$分析,结果偏大,故D错误;
E.读酸式滴定管开始时仰视,读数偏大,而读终点时俯视,读数偏小,二者之差偏小,造成V(标准)偏小,根据c(待测)=$\frac{c(标准)×V(标准)}{V(待测)}$分析,结果偏小,故E正确;
故答案为:ACE.
点评 本题考查中和滴定操作,题目难度中等,注意把握实验基本方法,能会分析导致误差的不当操作,注意把握实验操作要点和注意事项.

 阅读快车系列答案
阅读快车系列答案| A. | -OH与OH-具有相同的质子数 | |
| B. | 在葡萄糖溶液中加入银氨溶液,一会儿就会看到光亮的银析出 | |
| C. | 检验乙醇中是否含有水可用无水硫酸铜 | |
| D. | 某有机物在氧气中燃烧生成CO2和H2O,则该有机物可能是烃 |
| A. | 标准状况下,0.1 mol Cl2溶于水,转移的电子数目为0.1NA | |
| B. | 78 g Na2O2固体中含有的阴离子数为NA | |
| C. | 标准状况下,11.2 L CH3OH中含有的分子数目为0.5NA | |
| D. | 常温常压下,2.24 L CO和CO2混合气体中含有的碳原子数目为0.1NA |
| A. | 德国的维勒 | B. | 瑞典的贝采里乌斯 | ||
| C. | 德国的李比希 | D. | 匈牙利的海维西 |
| A. | 0.01mol 甲基(-CH3)所含电子数为0.07NA | |
| B. | 标准状况下,2.24L CH3Cl中所含分子数为0.1NA | |
| C. | 常温常压下,0.1mol/L CH3CH2OH溶液中含有的碳原子数目为0.2NA | |
| D. | 10 mL 0.1 mol/L HCHO溶液与足量的银氨溶液完全反应,转移电子的数目为2×10-3 NA |
| A. | 加工后具有吸水性的植物纤维可用作食品干燥剂 | |
| B. | 石油裂解、煤的干馏、玉米制醇、蛋白质的变性和纳米银粒子的聚集都是化学变化 | |
| C. | 以淀粉为原料可制取乙酸乙酯 | |
| D. | 食用花生油和鸡蛋清都能发生水解反应 |
| A. | 三种工艺均需采用加热和冷却装置 | |
| B. | 实验室中进行这三种操作时均需在烧瓶中进行 | |
| C. | 三种工艺均是物理变化过程 | |
| D. | 三种工艺均是化学变化过程 |
 .
.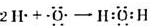 .
.