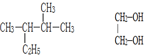题目内容
乙烯和乙醇的混合气体V L,完全燃烧消耗相同状态下的氧气3V L,则混合气体中乙烯和乙醇的体积比为( )
| A、1:1 | B、2:1 |
| C、1:2 | D、任意比 |
考点:化学方程式的有关计算,有关混合物反应的计算
专题:计算题
分析:根据物质的组成判断耗氧量,1mol烃CxHy的耗氧量为(x+
)mol,1mol烃含氧衍生物CxHyOz耗氧量为取(x+
-
)mol,据此计算1体积乙烯、乙醇蒸气消耗氧气的体积进行解答.
| y |
| 4 |
| y |
| 4 |
| z |
| 2 |
解答:
解:由于乙烯和乙醇的混合气体VL,完全燃烧后生成CO2和H2O,消耗相同状态下的氧气3VL,即1体积混合气体完全燃烧消耗3体积氧气,
乙烯分子式为C2H4,1体积乙烯消耗氧气为:(x+
)体积=(2+1)体积=3体积,
乙醇的分子式为C2H6O,1体积乙醇消耗氧气为:(2+
-
)体积=3体积,
故混合气体中乙烯和乙醇的体积比是任意比,
故选:D.
乙烯分子式为C2H4,1体积乙烯消耗氧气为:(x+
| y |
| 4 |
乙醇的分子式为C2H6O,1体积乙醇消耗氧气为:(2+
| 6 |
| 4 |
| 1 |
| 2 |
故混合气体中乙烯和乙醇的体积比是任意比,
故选:D.
点评:考查有机物耗氧量规律,难度较小,掌握有机物耗氧量规律,注意知识的归纳总结.

练习册系列答案
 阶梯计算系列答案
阶梯计算系列答案
相关题目
下列说法正确的是(NA 表示阿伏加德罗常数的值)( )
| A、常温常压下,16g CH4含有的氢原子数为4NA |
| B、1mol羟基(-OH)含有10NA个电子 |
| C、1mol?L-1NaOH溶液中含有的钠离子为NA |
| D、标准状况下,33.6L CH3CH2OH 中含有的分子数目为1.5NA |
易燃易爆有毒的化学物质在其包装上应贴上危险警告标签.下面所列物质贴错了标签的是( )
| A | B | C | D | |
| 物质的化学式 | 浓H2SO4 | CCl4 | P4 | NH4NO3 |
| 危险警告标签 | 腐蚀品 | 易燃品 | 剧毒品 | 爆炸品 |
| A、A | B、B | C、C | D、D |
为达到预期的实验目的,下列操作正确的是( )
| A、欲配制质量分数为10%的CuSO4溶液,将l0 g CuSO4?5H2O溶解在90 g水中 |
| B、将混有HCl的Cl2通入饱和NaHCO3溶液中除去HCl |
| C、为区别KCl、AlCl3和MgCl2溶液,分别向三种溶液中滴加NaOH溶液至过量 |
| D、用苯萃取溴水中的溴,分液时有机层从分液漏斗的下端放出 |
一定条件下,在容积固定的某密闭容器中发生的反应N2+3H2?2NH3.在10s内N2的浓度由5mol/L降至4mol/L.下列说法正确的是 ( )
| A、用NH3表示的化学反应速率为0.1 mol/(L?s) |
| B、维持容积的体积不变充入氩气,会加快该反应的速率 |
| C、增加H2的浓度该正反应速率和逆反应速率都会加快 |
| D、反应足够长时间,N2、H2中至少有一种物质浓度降为零 |
下列说法正确的是( )
| A、分散系中分散质粒子的直径:Fe(OH)3悬浊液>Fe(OH)3胶体>FeCl3溶液 |
| B、能自发进行的化学反应,一定是△H<0、△S>0 |
| C、焰色反应是物质燃烧时火焰呈现的颜色变化,属于化学变化 |
| D、钢铁发生电化学腐蚀时,负极的电极反应式为 Fe-3e-=Fe3+ |
 图中“-”表示相连的物质间在一定条件下可以反应,“-→”表示丁在一定条件下可以转化为乙.下面四组选项中,符合图示要求的是( )
图中“-”表示相连的物质间在一定条件下可以反应,“-→”表示丁在一定条件下可以转化为乙.下面四组选项中,符合图示要求的是( ) 表格中的各种情况,可用如图象表示的是( )
表格中的各种情况,可用如图象表示的是( )