题目内容
常温下将10ml PH=13的Ba(OH)2溶液加水稀释至100ml,所得溶液的PH为( )
| A、14 | B、12.7 |
| C、12 | D、10 |
考点:pH的简单计算
专题:电离平衡与溶液的pH专题
分析:pH=-lgc(H+),先根据溶液的pH计算氢氧根离子浓度,设稀释后的氢氧根离子浓度为c2,再根据c1V1=c2V2计算加入水后c2,结合Kw=c(H+)×c(OH-),求解氢离子浓度,根据H2O?H++OH-知,NaOH溶液中,氢离子浓度仅由水电离产生,根据pH=-lgc(H+).
解答:
解:pH=13的Ba(OH)2溶液中c(OH-)=0.1mol/L,加水稀释设稀释后的氢氧根离子浓度为c2,则c1V1=c2V2,0.1mol/L×10ml=c2×100ml,c2=0.01mol/L,Kw=c(H+)×c(OH-),c(H+)=
=
=10-12mol/L,pH=-lgc(H+)=12,
故选C.
| KW |
| C(H+) |
| 10-14 |
| 0.01mol/L |
故选C.
点评:本题考查了pH的简单计算,明确氢离子与氢氧根离子浓度的关系是解本题的关键,题目难度不大.

练习册系列答案
 名师导航单元期末冲刺100分系列答案
名师导航单元期末冲刺100分系列答案 名校名卷单元同步训练测试题系列答案
名校名卷单元同步训练测试题系列答案
相关题目
用NA表示阿伏加德罗常数,下列叙述正确的是( )
| A、标准状况下,22.4L H2含有的原子数为NA |
| B、等质量的O2和O3中所含的氧原子数相等 |
| C、常温常压下,14g N2含有电子数为7NA |
| D、28g CO与22.4L CO2所含的碳原子数相等 |
在化合反应、分解反应、置换反应、复分解反应四种化学反应中,可能有元素化合价发生变化的反应类型有( )
| A、一种 | B、两种 | C、三种 | D、四种 |
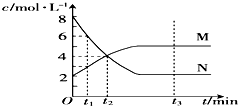 在一定温度下,容器内某一反应中M、N的物质的量浓度随反应时间变化的曲线如图.则下列表述中正确的是( )
在一定温度下,容器内某一反应中M、N的物质的量浓度随反应时间变化的曲线如图.则下列表述中正确的是( )| A、该反应的化学方程式为2N?M |
| B、t1时,M的浓度是N浓度的2倍 |
| C、t3时,正反应速率大于逆反应速率 |
| D、t2时,正、逆反应速率相等,化学反应达到了平衡 |
固定容积为2L的密闭容器中发生反应xA(g)+yB(g)?zC(g),图I表示200℃时容器中各物质的量随时间的变化关系,图Ⅱ表示平衡时平衡常数K随温度变化的关系.结合图象判断,下列结论正确的是( )


| A、200℃时,反应从开始到平衡的平均速率v(A)=0.08mol?L-1?min-1 |
| B、若0~5min时容器与外界的热交换总量为m kJ,则该反应的热化学方程式可表示为:2A(g)+B(g)?C(g)△H=+5m kJ/mol |
| C、200℃时,若在第6 min再向体系中充入1mol He,此时v正>v逆 |
| D、200℃时,平衡后再充入2mol C,则达到平衡时,C的体积分数等于0.25 |
下列事实中,不能用勒夏特列原理解释的是( )
| A、Fe(SCN)3溶液中加入固体KSCN后颜色变深 |
| B、向稀盐酸中加入少量蒸馏水,盐酸中氢离子浓度降低 |
| C、实验室常用排饱和食盐水的方法收集氯气 |
| D、棕红色NO2加压后颜色先变深后变浅 |
下列方法不能用于区分二氧化硫和二氧化碳的是( )
| A、通入品红溶液 |
| B、通入澄清石灰水中 |
| C、通入溴水中 |
| D、通入酸性KMnO4溶液中 |
 请按以下要求,回答下列相应问题:
请按以下要求,回答下列相应问题: