题目内容
11.已知反应O2(g)+2Cl2(g)?2Cl2O(g)△H>0.在三个恒温、恒容的密闭容器中分别充入1mol O2与2mol Cl2,测得平衡时O2的转化率如表:| 容器编号 | 温度/℃ | 容器体 积/L | 平衡时O2转化率 | 平衡时 压强/Pa |
| ① | 200 | V1 | 50% | p1 |
| ② | 200 | V2 | 70% | p2 |
| ③ | 350 | V3 | 50% | p3 |
| A. | 起始反应速率:③>①>② | |
| B. | 平衡时压强:p1>p2 | |
| C. | 容器体积:V1<V3 | |
| D. | 若实验②中O2和Cl2用量均加倍,则平衡时O2的转化率小于70% |
分析 A、根据温度高,压强大反应速率大判断;
B、根据②平衡时O2转化率比①大,说明平衡时②中气体的物质的量比①少;
C、③和①O2转化率的转化率相同,又该反应为吸热反应,③的温度高平衡向正反应方向移动,所以③的压强使平衡向逆反应方向移动,据此分析;
D、若实验②中O2和Cl2用量均加倍,相当于增大压强,平衡正向移动,则O2转化率大于70%.
解答 解:A、②平衡时O2转化率比①大,说明②相对于①平衡向正反应方向移动,所以开始时压强:p1<p2,则反应速率②>①,故A错误;
B、温度相同,②平衡时O2转化率比①大,说明平衡时压强:p1<p2,故B错误;
C、③和①O2转化率的转化率相同,又该反应为吸热反应,③的温度高平衡向正反应方向移动,所以③的压强使平衡向逆反应方向移动,即压强小于①,所以体积大于①,V1<V3,故C正确;
D、若实验②中O2和Cl2用量均加倍,相当于增大压强,平衡正向移动,则O2转化率大于70%,故D错误;
故选:C.
点评 本题考查外界条件对化学反应速率和平衡移动的影响,注意影响化学反应速率的因素与影响平衡移动的因素,题目难度不大.

练习册系列答案
相关题目
5.部分短周期元素的有关信息如表所示
根据表中信息,判断以下叙述正确的是( )
| 元素代号 | 元素性质或原子结构 |
| T | 第二层上的电子数是第一层的3倍 |
| R | 与T 同一族 |
| L | L2+与T2-的核外电子数相等 |
| Z | 元素最高正价是+3价,与L同周期 |
| A. | 氢化物的稳定性为H2T<H2R | |
| B. | 单质与稀盐酸反应的速率为L<Z | |
| C. | Z与T形成的化合物具有两性 | |
| D. | L与R通过离子键形成的化合物阴阳离子的核外电子数相等 |
2.下列关于气体摩尔体积的说法正确的是( )
| A. | 标准状况下,1mol任何气体物质的体积都约为22.4L | |
| B. | 1mol气体的体积约为22.4L | |
| C. | 标准状况下,1molO2和N2混合气(任意比)的体积约为22.4L | |
| D. | 任何条件下,气体的摩尔体积都是22.4L |
6.苯乙烯是化工产品中最重要的单体之一.在工业上,
苯乙烯由乙苯和CO2催化脱氢制得.总反应原理如下:
 (g)+CO2(g)?
(g)+CO2(g)?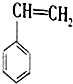 (g)+CO(g)+H2O(g)△H
(g)+CO(g)+H2O(g)△H
回答下列问题:
(1)已知:
由乙苯制取苯乙烯反应的△H=+158.8KJ/mol
(2)在温度为T1时,该反应的平衡常熟K=0.5mol/L.在2L的密闭容器中加入乙苯与CO2,反应到某时刻测得该混合物各组分的物质的量均为1.0mol.
①该时刻化学反应是(填“是”或“不是”)处于平衡状态.
②下列叙述能说明乙苯与C02在该条件下于平衡状态的是AD(填正确答案编号).
A.正、逆反应速率的比值恒定 B.c(CO2)=c(CO)
C.混合气体的密度不变 D.CO2的体积分数保持不变
③若将反应改为恒压绝热条件下进行,达到平衡时,则乙苯的物质的量浓度d(填正确答案编号).
a、大于0.5mol/L b、小于0.5mol/L c、等于0.5mol/Ld、不确定
(3)在温度为T2时的恒定容器中,乙苯、CO2的起始浓度分别为1.0mol/L和2.0mol/L,设反应平衡后总压强为P、起始压强为P0,则反应达到平衡时苯乙烯的浓度为$\frac{5(P-{P}_{0})}{{P}_{0}}$,乙苯的转化率为$\frac{2.5(P-{P}_{0})}{{P}_{0}}$×100%(均用含P0、P的表达式表示).
(4)写出由苯乙烯在一定条件下合成聚苯乙烯的化学方程式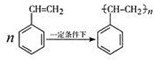 .
.
苯乙烯由乙苯和CO2催化脱氢制得.总反应原理如下:
 (g)+CO2(g)?
(g)+CO2(g)? (g)+CO(g)+H2O(g)△H
(g)+CO(g)+H2O(g)△H回答下列问题:
(1)已知:
| 化学键 | C-H | C-C | C=C | C=O | CO | O-H |
| 键能/kJ/mol | 413 | 348 | 615 | 745 | 1076 | 463 |
(2)在温度为T1时,该反应的平衡常熟K=0.5mol/L.在2L的密闭容器中加入乙苯与CO2,反应到某时刻测得该混合物各组分的物质的量均为1.0mol.
①该时刻化学反应是(填“是”或“不是”)处于平衡状态.
②下列叙述能说明乙苯与C02在该条件下于平衡状态的是AD(填正确答案编号).
A.正、逆反应速率的比值恒定 B.c(CO2)=c(CO)
C.混合气体的密度不变 D.CO2的体积分数保持不变
③若将反应改为恒压绝热条件下进行,达到平衡时,则乙苯的物质的量浓度d(填正确答案编号).
a、大于0.5mol/L b、小于0.5mol/L c、等于0.5mol/Ld、不确定
(3)在温度为T2时的恒定容器中,乙苯、CO2的起始浓度分别为1.0mol/L和2.0mol/L,设反应平衡后总压强为P、起始压强为P0,则反应达到平衡时苯乙烯的浓度为$\frac{5(P-{P}_{0})}{{P}_{0}}$,乙苯的转化率为$\frac{2.5(P-{P}_{0})}{{P}_{0}}$×100%(均用含P0、P的表达式表示).
(4)写出由苯乙烯在一定条件下合成聚苯乙烯的化学方程式
 .
.
20.某些化学键的键能数据如下表:
反应:CO2(g)+3H2(g)?CH3OH(g)+H2O(g)的焓变△H=-178kJ/mol,△S<0(填>,<,=)
| 化学键 | C-C | C-H | H-H | C-O | C=O | H-O |
| 键能/kJ•mol-1 | 348 | 413 | 436 | 358 | 750 | 463 |

