题目内容
17.下列离子方程式正确的是( )| A. | 氯化铝溶液中加入过量氨水:Al3++4NH3•H2O═[Al(OH)4]-+4NH4+ | |
| B. | MgSO4溶液中加入Ba(OH)2溶液:SO42-+Ba2+=BaSO4↓ | |
| C. | 硫化钠溶液显碱性:S2-+2H2O═H2S+2OH- | |
| D. | NaHCO3溶液加入少量Ca(OH)2溶液:2HCO3-+Ca2++2OH-=CaCO3↓+2H2O+CO32- |
分析 A.氨水为弱碱,二者反应生成氢氧化铝沉淀;
B.漏掉了镁离子与氢氧根离子生成氢氧化镁沉淀的反应;
C.硫离子的水解分步进行,离子方程式需要分步书写,且主要以第一步为主;
D.氢氧化钙少量,反应生成碳酸钠、碳酸钡沉淀和水.
解答 解:A.氯化铝溶液中加入过量氨水,反应生成氢氧化铝沉淀和氯化铵,正确的离子方程式为:Al3++3NH3•H2O=Al(OH)3↓+3NH4+,故A错误;
B.MgSO4溶液中加入Ba(OH)2溶液,反应生成硫酸钡和氢氧化镁沉淀,正确的离子方程式为:SO42-+Ba2++Mg2++2OH-=Mg(OH)2↓+BaSO4↓,故B错误;
C.硫化钠溶液中,硫离子部分水解,溶液显碱性,其水解主要以第一步为主,正确的水解方程式为:S2-+H2O═HS-+OH-,故C错误;
D.NaHCO3溶液加入少量Ca(OH)2溶液,离子方程式按照氢氧化钙的组成书写,反应的离子方程式为:2HCO3-+Ca2++2OH-=CaCO3↓+2H2O+CO32-,故D正确;
故选D.
点评 本题考查了离子方程式的书写判断,题目难度中等,注意明确离子方程式正误判断常用方法:检查反应物、生成物是否正确,检查各物质拆分是否正确,如难溶物、弱电解质等需要保留化学式,检查是否符合原化学方程式等.

练习册系列答案
相关题目
7.下列颜色变化过程中无化学反应发生的是( )
| A. | 蛋白质遇浓硝酸变黄 | |
| B. | 含钠元素的物质在火焰上灼烧产生黄色火焰 | |
| C. | pH试纸与某溶液接触变为红色 | |
| D. | 无色浓硝酸久置后变黄 |
8.将2.32g Na2CO3、NaOH的固体混合物完全溶解于水,制成溶液,然后向该溶液中缓慢逐滴加入浓度为 0.1 mol/L的盐酸,所加盐酸的体积与产生CO2的体积(标准状况)关系如图所示,下列说法中错误的是( )
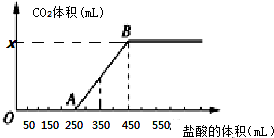

| A. | OA段发生反应的离子方程式为:H++OH-═H2O CO32-+H+═HCO3- | |
| B. | 当加入350 mL盐酸时,产生CO2的体积为224 mL(标准状况) | |
| C. | x点对应的数值是448 | |
| D. | 混合物中NaOH的质量为1克 |
2.Mg SO2 H2SO4 NaOH NaCl的顺序是按某一分类规律排列的.下列物质的排序符合此分类规律的是( )
| A. | Na2CO3 C CO2 Ca(OH)2 HNO3 | B. | Na3PO4 Na SO2 H2SO3 KOH | ||
| C. | Si CO2 H3PO4 Ba(OH)2 Na2S | D. | N2 NO HNO3 NH3 NaBr |
9.下列试剂保存方法或实验方法不正确的是( )
| A. | 盛浓硝酸、硝酸银用棕色试剂瓶,并置于阴凉处 | |
| B. | 用带玻璃塞的磨口玻璃瓶盛氢氧化钠 | |
| C. | 金属钠通常保存在煤油里 | |
| D. | HF酸储存在塑料瓶中 |
 +HNO3$→_{△}^{浓硫酸}$
+HNO3$→_{△}^{浓硫酸}$ +H2O
+H2O +3H2$→_{△}^{Ni}$
+3H2$→_{△}^{Ni}$