题目内容
12.某氯碱厂电解饱和食盐水制取NaOH的工艺流程示意图如图: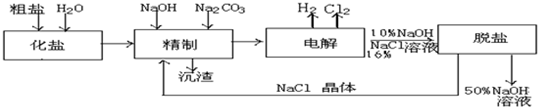
依据图,完成下列填空:
(1)在电解过程中,与电源正极相连的电极上所发生反应的化学方程式为2Cl--2e-═Cl2↑;与电源负极相连的电极附近,溶液pH值升高.(选填:不变、升高或下降)
(2)工业食盐含Ca2+、Mg2+等杂质,精制过程发生反应的离子方程式为Ba2++SO42-=BaSO4↓,Mg2++2OH-=Mg(OH)2↓,Ca2++CO32-=CaCO3↓,Ba2++CO32-=BaCO3↓;
(3)如果粗盐中SO42-含量较高,必须添加钡试剂除去SO42-,该钡试剂可以是ac(选填a、b、c多选倒扣分)
a.Ba(OH)2 b.Ba(NO3)2 c.BaCl2
(4)为有效除去Ca2+、Mg2+、SO42-,加入试剂的合理顺序为bc(选填a、b、c多选倒扣分)
a.先加NaOH,后加Na2CO3,再加钡试剂
b.先加NaOH,后加钡试剂,再加Na2CO3
c.先加钡试剂,后加NaOH,再加Na2CO3
(5)脱盐工序中利用NaOH和NaCl在溶解度上的差异,通过浓缩、冷却、过滤(填写操作名称)除去NaCl.
(6)在隔膜法电解食盐水时,电解槽分隔为阳极区和阴极区,防止Cl2与NaOH反应;采用无隔膜电解冷的食盐水时,Cl2与NaOH充分接触,产物仅是NaClO和H2,相应的化学方程式为2NaCl+2H2O$\frac{\underline{\;电解\;}}{\;}$2NaOH+Cl2↑+H2↑;Cl2+2NaOH=NaCl+NaClO+H2O.
分析 (1)在电解过程中,与电源正极相连的电极上氯离子放电生成氯气;与电源负极相连的电极上氢离子放电生成氢气,同时阴极附近有NaOH生成,导致溶液碱性增强;
(2)精制过程中,加入氯化钡,可以将杂质离子硫酸根除去;加入氢氧化钠,可以将杂质离子镁离子除去;加入碳酸钠,即可以将杂质钙离子除去,还可以将多余的钡离子除去;
(3)添加钡试剂除去SO42-,注意不能引入新的杂质;
(4)有效除去Ca2+、Mg2+、SO42-,应注意碳酸钠在钡试剂之后;
(5)由于NaOH的溶解度大于NaCl,通过蒸发浓缩、冷却、结晶和过滤后可除去后经过滤除去NaCl;
(6)电解氯化钠溶液生成氯气、氢气和氢氧化钠溶液,氯气和氢氧化钠溶液反应生成氯化钠、次氯酸钠和水.
解答 解:(1)电解食盐水,与正极相连为阳极,生成氯气,该电极反应为2Cl--2e-═Cl2↑,与电源负极相连为阴极,生成氢气和NaOH,生成碱,所以pH升高,
故答案为:2Cl--2e-═Cl2↑;升高;
(2)精制过程中,加入氯化钡,可以将杂质离子硫酸根除去,即Ba2++SO42-=BaSO4↓,加入氢氧化钠,可以将杂质离子镁离子除去,即Mg2++2OH-=Mg(OH)2↓,加入碳酸铵,即可以将杂质钙离子除去,还可以将多余的钡离子除去,即Ca2++CO32-=CaCO3↓,Ba2++CO32-=BaCO3↓,
故答案为:Ba2++SO42-=BaSO4↓,Mg2++2OH-=Mg(OH)2↓,Ca2++CO32-=CaCO3↓,Ba2++CO32-=BaCO3↓;
(3)添加钡试剂除去SO42-,注意不能引入新的杂质,选Ba(NO3)2会引入杂质硝酸根离子,所以选ac,故答案为:ac;
(4)有效除去Ca2+、Mg2+、SO42-,应注意碳酸钠在钡试剂之后,是为除去过量的钡离子,显然只有选项bc符合,故答案为:bc;
(5)氢氧化钠的溶解度随温度的升高而增大,但是氯化钠的溶解度受温度的影响不大,则在温度高的时候,生成氢氧化钠晶体即可除去氯化钠,所以氢氧化钠和氯化钠分离的方法是:蒸发浓缩、冷却、结晶、过滤;
故答案为:浓缩;过滤;
(6)电解氯化钠溶液生成氯气、氢气和氢氧化钠溶液,氯气和氢氧化钠溶液反应生成氯化钠、次氯酸钠和水;反应的化学方程式为:2NaCl+2H2O$\frac{\underline{\;电解\;}}{\;}$2NaOH+Cl2↑+H2↑、Cl2+2NaOH=NaCl+NaClO+H2O;
故答案为:2NaCl+2H2O$\frac{\underline{\;电解\;}}{\;}$2NaOH+Cl2↑+H2↑;Cl2+2NaOH=NaCl+NaClO+H2O.
点评 本题考查粗盐提纯、电解原理等知识点,明确离子发生的反应、离子放电顺序及物质性质是解本题关键,注意除杂时要除去杂质且不能引进新的杂质,注意(4)题加入除杂剂的先后顺序,为易错点.

| A. |  溶解食盐 | B. | 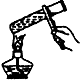 蒸发结晶 | C. |  进行定容 | D. | 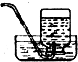 收集NO2 |
| A. | 将作物秸秆通过化学反应转化为乙醇用作汽车燃料 | |
| B. | 使用资源节约型、环境友好型的生物降解塑料包装袋 | |
| C. | 大力研发新型有机溶剂替代水作为萃取剂 | |
| D. | 利用CO2合成聚碳酸酯类可降解塑料,实现“碳”的循环利用 |
| A. | 氯化铝溶液中加入过量氨水:Al3++4NH3•H2O═[Al(OH)4]-+4NH4+ | |
| B. | MgSO4溶液中加入Ba(OH)2溶液:SO42-+Ba2+=BaSO4↓ | |
| C. | 硫化钠溶液显碱性:S2-+2H2O═H2S+2OH- | |
| D. | NaHCO3溶液加入少量Ca(OH)2溶液:2HCO3-+Ca2++2OH-=CaCO3↓+2H2O+CO32- |
| A. | Fe3+ NH4+ SCN- Cl- | B. | Fe3+ Fe2+ Na+ NO3- | ||
| C. | Ba2+ H+ NO3- SO42- | D. | S2- Na+ ClO- OH- |
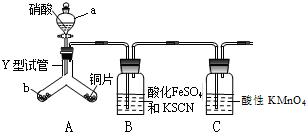 为探究铜与6mol•L-1硝酸反应的气态产物中是否含NO2,进行如下实验.
为探究铜与6mol•L-1硝酸反应的气态产物中是否含NO2,进行如下实验.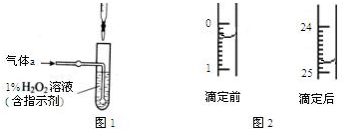
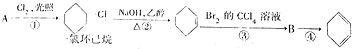
 ,②的反应类型是消去反应.
,②的反应类型是消去反应. .
.