题目内容
W、X、Y、Z是元素周期表中常见的短周期元素,其原子序数依次增大,相关信息如下:
(1)Y位于周期表第 周期第 族,Z基态原子的核电子排布式为 .
(2)W、X、Y的第一电离能从小到大的顺序是 (用元素符号表示).
(3)W的一种氢化物相对分子质量为26;其分子中的σ键与π键的键数之比为 ;化合物WY2的电子式是 .
(4)X和Z的最高价氧化物对应水化物相互反应的离子方程式为 .
(5)已知下列数据:Fe(s)+
O2(g)=FeO(s)△H=-272.0KJ?ol-1 4Z(s)+3O2(g)=2Z2O3(s)△H=-3351.4KJ?mol-1Z的单质和FeO反应的热化学方程式是 .
| 元素代号 | 相关信息 |
| W | W的基态原子核外3个能级上有电子,且每个能级上的电子数相等. |
| X | X原子核外L层电子数为奇数 |
| Y | Y是地壳中含量最多的元素 |
| Z | Z在同周期元素的简单离子中半径最小 |
(2)W、X、Y的第一电离能从小到大的顺序是
(3)W的一种氢化物相对分子质量为26;其分子中的σ键与π键的键数之比为
(4)X和Z的最高价氧化物对应水化物相互反应的离子方程式为
(5)已知下列数据:Fe(s)+
| 1 |
| 2 |
考点:位置结构性质的相互关系应用
专题:元素周期律与元素周期表专题
分析:W、X、Y、Z是常见的短周期元素,原子序数依次增大,W的基态原子核外3个能级上有电子,且每个能级上的电子数相等,则核外电子排布为1s22s22p2,故W为碳元素;
Y是地壳中含量最多的元素,Y为氧元素;
X原子核外L层电子数为奇数,则X有2个电子层,原子序数介于碳元素、氧元素之间,故X为氮元素;
Z在同周期元素的简单离子中半径最小,则Z形成的离子为阳离子,原子序数大于氧元素,故Z处于第三周期,为Al元素,据此解答.
Y是地壳中含量最多的元素,Y为氧元素;
X原子核外L层电子数为奇数,则X有2个电子层,原子序数介于碳元素、氧元素之间,故X为氮元素;
Z在同周期元素的简单离子中半径最小,则Z形成的离子为阳离子,原子序数大于氧元素,故Z处于第三周期,为Al元素,据此解答.
解答:
解:W、X、Y、Z是元素周期表中常见的短周期元素,其原子序数依次增大,W的基态原子核外3个能级上有电子,且每个能级上的电子数相等,则核外电子排布为1s22s22p2,故W为碳元素;Y是地壳中含量最多的元素,Y为氧元素,X原子核外L层电子数为奇数,则X有2个电子层,原子序数介于碳元素、氧元素之间,故X为氮元素;Z在同周期元素的简单离子中半径最小,则Z形成的离子为阳离子,原子序数大于氧元素,故Z处于第三周期,为Al元素,
(1)Y为氧元素,位于周期表第二周期第ⅥA族,Z为为Al元素,原子核外电子数为13,基态原子的核外电子排布式为:1s22s22p63s23p1,故答案为:二;ⅥA;1s22s22p63s23p1;
(2)同周期自左而右第一电离呈增大趋势,但N元素原子2p能级有3个电子,处于半满稳定状态,能量较低,失去电子需要的能量较大,第一电离能高于相邻元素,故第一电离能C<O<N,故答案为:C<O<N;
(3)C元素的一种氢化物相对分子质量为26,为C2H2,分子中含有1个C≡C三键、2个C-H键,三键中有1个σ键、2个π键,单键都是σ键,故其分子中的σ键与π键的键数之比为3:2,化合物WY2是CO2,碳原子与氧原子之间形成2对共用电子对,故电子式是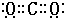 ,故答案为:3:2;
,故答案为:3:2;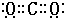 ;
;
(4)X和Z的最高价氧化物对应水化物分别为HNO3、Al(OH)3,反应的离子方程式为:3H++Al(OH)3=Al3++3H2O,故答案为:3H++Al(OH)3=Al3++3H2O;
(5)已知:①、Fe(s)+
O2(g)=FeO(s)△H=-272.0KJ?mol-1
②、4Al(s)+3O2(g)=2Al2O3(s)△H=-3351.4KJ?mol-1
根据盖斯定律,②×
-①×3得2Al(s)+3FeO(s)=Al2O3 (s)+3Fe(s),
故△H=
×(-3351.4KJ?mol-1)-(-272.0KJ?mol-1)×3=-859.7KJ/mol
故Al和FeO反应的热化学方程式为:2Al(s)+3FeO(s)=Al2O3 (s)+3Fe(s)△H=-859.7KJ/mol,
故答案为:2Al(s)+3FeO(s)=Al2O3 (s)+3Fe(s)△H=-859.7KJ/mol.
(1)Y为氧元素,位于周期表第二周期第ⅥA族,Z为为Al元素,原子核外电子数为13,基态原子的核外电子排布式为:1s22s22p63s23p1,故答案为:二;ⅥA;1s22s22p63s23p1;
(2)同周期自左而右第一电离呈增大趋势,但N元素原子2p能级有3个电子,处于半满稳定状态,能量较低,失去电子需要的能量较大,第一电离能高于相邻元素,故第一电离能C<O<N,故答案为:C<O<N;
(3)C元素的一种氢化物相对分子质量为26,为C2H2,分子中含有1个C≡C三键、2个C-H键,三键中有1个σ键、2个π键,单键都是σ键,故其分子中的σ键与π键的键数之比为3:2,化合物WY2是CO2,碳原子与氧原子之间形成2对共用电子对,故电子式是
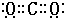 ,故答案为:3:2;
,故答案为:3:2;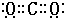 ;
;(4)X和Z的最高价氧化物对应水化物分别为HNO3、Al(OH)3,反应的离子方程式为:3H++Al(OH)3=Al3++3H2O,故答案为:3H++Al(OH)3=Al3++3H2O;
(5)已知:①、Fe(s)+
| 1 |
| 2 |
②、4Al(s)+3O2(g)=2Al2O3(s)△H=-3351.4KJ?mol-1
根据盖斯定律,②×
| 1 |
| 2 |
故△H=
| 1 |
| 2 |
故Al和FeO反应的热化学方程式为:2Al(s)+3FeO(s)=Al2O3 (s)+3Fe(s)△H=-859.7KJ/mol,
故答案为:2Al(s)+3FeO(s)=Al2O3 (s)+3Fe(s)△H=-859.7KJ/mol.
点评:本题主要考查结构性质位置关系、核外电子排布规律、电离能、化学键、电子式等常用化学用语、热化学反应方程式书写等,题目较为综合,难度不大.

练习册系列答案
相关题目
下列关于氧化物的叙述正确的是( )
| A、能跟强碱溶液反应的氧化物就是酸性氧化物 |
| B、酸性氧化物都可以与水反应可生成酸 |
| C、金属氧化物不一定是碱性氧化物 |
| D、不能跟酸反应的氧化物一定能和碱反应 |
下列解释实验事实的方程式不正确的是( )
| A、可用氯气进行自来水的杀菌消毒:Cl2+H2O═HCl+HClO |
| B、将“NO2球”浸泡在热水中,颜色变深:2NO2(g)═N2O4(g)△H<0 |
| C、在刻制印刷电路板时,用FeCl3溶液腐蚀铜箔:2Fe3++3Cu═2Fe+3Cu2+ |
| D、在KNO3和稀硫酸混合液中,铜片溶解:3Cu+8H++2NO3-═3Cu2++2NO↑+4H2O |
用标准的NaOH溶液滴定未知浓度的盐酸,选用酚酞作指示剂,可导致被测定的盐酸浓度偏高的是( )
| A、未用标准液润洗用蒸馏水洗过的碱式滴定管 |
| B、达到滴定终点,读数时俯视滴定管的刻度 |
| C、滴定过程中振荡锥形瓶有少许盐酸溅出 |
| D、盛装待测液的锥形瓶用蒸馏水洗过,未用待测液润洗 |