题目内容
下列叙述Ⅰ和Ⅱ均正确并有因果关系的是( )
| A、较强酸可制较弱酸,次氯酸无法制盐酸 |
| B、Ca(OH)2能制成澄清石灰水,次氯酸无法制盐酸 |
| C、KNO3的溶解度大,用重结晶法除去KNO3中混有的NaCl |
| D、BaSO4难溶于酸,用盐酸和BaCl2溶液检验SO42- |
考点:硫酸根离子的检验,物质的分离、提纯和除杂
专题:
分析:A.次氯酸分解生成氯化氢和氧气;
B.较强酸可制较弱酸;
C.利用二者溶解度随温度变化不同进行分离;
D.BaSO4难溶于酸,先加入盐酸可排除Ag+或SO32-的影响.
B.较强酸可制较弱酸;
C.利用二者溶解度随温度变化不同进行分离;
D.BaSO4难溶于酸,先加入盐酸可排除Ag+或SO32-的影响.
解答:
解:A.次氯酸分解生成氯化氢和氧气,可得到盐酸,故A错误;
B.Ca(OH)2能制成澄清石灰水与次氯酸无法制盐酸无因果关系,故B错误;
C.用重结晶法出气硝酸钾中混有的氯化钠,是因为硝酸钾的溶解度随温度的变化而变化很明显,而氯化钠基本不变,当温度降低时,硝酸钾溶解度迅速减小,氯化钠基本不变,所以降低温度时,硝酸钾迅速析出,氯化钠不析出,这并非由于硝酸钾的溶解度大造成的,故C错误;
D.硫酸钡难溶于酸,加入盐酸没有沉淀,可以排除银离子的干扰,加入氯化钡产生沉淀,沉淀为硫酸钡,由此可以检验是否含有SO42-,故D正确.
故选D.
B.Ca(OH)2能制成澄清石灰水与次氯酸无法制盐酸无因果关系,故B错误;
C.用重结晶法出气硝酸钾中混有的氯化钠,是因为硝酸钾的溶解度随温度的变化而变化很明显,而氯化钠基本不变,当温度降低时,硝酸钾溶解度迅速减小,氯化钠基本不变,所以降低温度时,硝酸钾迅速析出,氯化钠不析出,这并非由于硝酸钾的溶解度大造成的,故C错误;
D.硫酸钡难溶于酸,加入盐酸没有沉淀,可以排除银离子的干扰,加入氯化钡产生沉淀,沉淀为硫酸钡,由此可以检验是否含有SO42-,故D正确.
故选D.
点评:本题考查强酸反应制取弱酸、混合物分离提纯以及物质的检验和鉴别,为高频考点,把握物质的性质及混合物分离方法、原理为解答的关键,选项C为解答的易错点,题目难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
某同学在实验报告中记录下列数据,其中正确的是( )
| A、用25ml量筒量取18.65ml水 |
| B、用广泛pH试纸测得某溶液的pH为5 |
| C、称取10.1gNaOH时,取出标定为10g的砝码放在右盘上,并将游码右移到0.1g的位置 |
| D、用250ml容量瓶配制100mlNaCl溶液 |
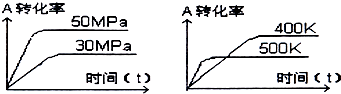 如图表示可逆反应mA(g)+nB(s)?xC(g)在不同温度和压强下,反应物A的转化率变化情况.下列判断正确的是( )
如图表示可逆反应mA(g)+nB(s)?xC(g)在不同温度和压强下,反应物A的转化率变化情况.下列判断正确的是( )| A、m>x,正反应为放热反应 |
| B、m+n<x,正反应为吸热反应 |
| C、m<x,正反应为放热反应 |
| D、m>x,正反应为吸热反应 |
下列情况下,埋在地下的输油铸铁管道被腐蚀最慢的是( )
| A、潮湿疏松透气的土壤中 |
| B、含铁元素较多的酸性土壤中 |
| C、干燥致密不透气的土壤中 |
| D、含碳量较高,潮湿透气的中性土壤中 |
 意大利罗马大学的FulvioCacace等人获得了极具理论研究意义的N4分子.N4分子结构如图所示,已知N-N键能167kJ?mol-1N≡N键能942kJ?mol-1.根据以上信息和数据,能判断且说法正确的是( )
意大利罗马大学的FulvioCacace等人获得了极具理论研究意义的N4分子.N4分子结构如图所示,已知N-N键能167kJ?mol-1N≡N键能942kJ?mol-1.根据以上信息和数据,能判断且说法正确的是( )| A、N4属于一种新型的化合物 |
| B、N4与N2互为同素异形体 |
| C、N4比P4(白磷)更稳定 |
| D、N4气体转变为N2将吸收能量 |