题目内容
 意大利罗马大学的FulvioCacace等人获得了极具理论研究意义的N4分子.N4分子结构如图所示,已知N-N键能167kJ?mol-1N≡N键能942kJ?mol-1.根据以上信息和数据,能判断且说法正确的是( )
意大利罗马大学的FulvioCacace等人获得了极具理论研究意义的N4分子.N4分子结构如图所示,已知N-N键能167kJ?mol-1N≡N键能942kJ?mol-1.根据以上信息和数据,能判断且说法正确的是( )| A、N4属于一种新型的化合物 |
| B、N4与N2互为同素异形体 |
| C、N4比P4(白磷)更稳定 |
| D、N4气体转变为N2将吸收能量 |
考点:反应热和焓变
专题:化学反应中的能量变化
分析:A、只有N元素组成,是一种单质;
B、依据同素异形体的概念分析;
C、根据影响分子晶体的熔沸点高低的因素分析;
D、根据化学键断裂要吸收热量,形成化学键要放出热量,分别计算后进行比较;
B、依据同素异形体的概念分析;
C、根据影响分子晶体的熔沸点高低的因素分析;
D、根据化学键断裂要吸收热量,形成化学键要放出热量,分别计算后进行比较;
解答:
解:A、N4由N组成,是一种单质,而化合物是由不同元素组成的纯净物,故A错误;
B、N4与N2是同种元素形成的不同单质,是同素异形体,故B正确;
C、N4和P4都是分子晶体,并且结构相似,N与P属于同一主族,N的非金属性比P强,所以N4比P4活泼,故C错误;
D、1molN4气体中含有6molN-N键,可生成2molN2,形成2molN≡N键,则1molN4气体转变为N2化学键断裂断裂吸收的热量为6×167KJ=1002KJ,形成化学键放出的热量为1884KJ,所以反应放热,放出的热量为1884KJ-1002KJ=882KJ,故应为放出热量,故D错误.
故选B.
B、N4与N2是同种元素形成的不同单质,是同素异形体,故B正确;
C、N4和P4都是分子晶体,并且结构相似,N与P属于同一主族,N的非金属性比P强,所以N4比P4活泼,故C错误;
D、1molN4气体中含有6molN-N键,可生成2molN2,形成2molN≡N键,则1molN4气体转变为N2化学键断裂断裂吸收的热量为6×167KJ=1002KJ,形成化学键放出的热量为1884KJ,所以反应放热,放出的热量为1884KJ-1002KJ=882KJ,故应为放出热量,故D错误.
故选B.
点评:本题考查较为综合,涉及物质的组成和分类、原子结构、同素异形体、同位数的概念,反应热的计算等问题,题目难度不大,注意基础知识的把握.

练习册系列答案
 鹰派教辅衔接教材河北教育出版社系列答案
鹰派教辅衔接教材河北教育出版社系列答案 初中暑期衔接系列答案
初中暑期衔接系列答案
相关题目
下列叙述Ⅰ和Ⅱ均正确并有因果关系的是( )
| A、较强酸可制较弱酸,次氯酸无法制盐酸 |
| B、Ca(OH)2能制成澄清石灰水,次氯酸无法制盐酸 |
| C、KNO3的溶解度大,用重结晶法除去KNO3中混有的NaCl |
| D、BaSO4难溶于酸,用盐酸和BaCl2溶液检验SO42- |
如图所示,由锌片、铜片和稀硫酸溶液构成的原电池中,下列叙述正确的是( )
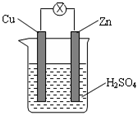

| A、锌片为负极,发生还原反应 |
| B、电流从锌片流向铜片 |
| C、一段时间后,铜片质量减轻 |
| D、一段时间后,溶液pH值变大 |
下列各溶液中,Na+浓度最大的是( )
| A、0.8L 0.4mol/L的NaOH溶液 |
| B、0.1L 0.5mol/L的NaCl溶液 |
| C、1L 0.3mol/L的NaCl溶液 |
| D、0.2L0.25mol/L的Na3PO4溶液 |
下列表示对应化学反应的离子方程式正确的是( )
A、电解饱和NaCl溶液:2Cl-+2H+
| ||||
| B、向Na2SO3溶液中滴加足量NaClO溶液:SO32-+ClO-=SO42-+Cl- | ||||
| C、向FeBr2溶液中通入足量Cl2:2Fe2++Cl2=2Fe3++2Cl- | ||||
| D、向Ca(OH)2溶液中加少量NaHCO3溶液:2 HCO3-+Ca2++2OH-=CaCO3↓+CO32-+2H2O |
下列变化中,属于吸热反应的是( )
| A、木炭燃烧反应 |
| B、酸碱中和反应 |
| C、铝和盐酸反应 |
| D、氢氧化钡晶体和氯化铵晶体反应 |
下列分散系不能发生丁达尔现象的是( )
| A、豆浆 | B、牛奶 | C、蔗糖溶液 | D、雾 |
下列不属于物理量的是( )
| A、物质的量 | B、摩尔 |
| C、阿伏伽德罗常数 | D、物质的量浓度 |