题目内容
6.设NA为阿伏加德罗常数的值.下列叙述正确的是( )| A. | 3 mol NF3与水完全反应生成HNO3和NO,转移电子数为2NA | |
| B. | 4.4 g14CO2含中子数为2.4NA | |
| C. | 标准状况下,2.24 L Cl2通入足量NaOH溶液中,反应转移电子的数目为0.2NA | |
| D. | 常温常压下,1.7 g H2O2中含有的电子数为NA |
分析 A、NF3与水的反应为:3NF3+5H2O═2NO+HNO3+9HF,转移2mol电子;
B、14CO2的摩尔质量为46g/mol;
C、氯气与氢氧化钠的反应为歧化反应;
D、求出双氧水的物质的量,然后根据1mol双氧水中含18mol电子来分析.
解答 解:A、NF3与水的反应为:3NF3+5H2O═2NO+HNO3+9HF,此转移2mol电子即2NA个,反应掉3molNF3,故A正确;
B、14CO2的摩尔质量为46g/mol,故4.4g14CO2的物质的量n=$\frac{4.4g}{46g/mol}$=0.096mol,而1mol14CO2中含24mol中子,故0.096mol14CO2中含2.3mol中子即2.3NA个中子,故B错误;
C、标况下,2.24L氯气的物质的量为0.1mol,而氯气与氢氧化钠的反应为歧化反应,0.1mol氯气反应转移0.1mol电子即0.1NA个,故C错误;
D、1.7g双氧水的物质的量为n=$\frac{1.7g}{34g/mol}$=0.05mol,而1mol双氧水中含18mol电子,故0.05mol双氧水中含0.9mol电子即0.9NA个,故D错误.
故选A.
点评 本题考查了阿伏伽德罗常数的有关计算,熟练掌握公式的使用和物质的结构是解题关键,难度不大.

练习册系列答案
相关题目
16.下列各组物质发生化学反应时,由于反应物的量不同而生成不同产物的是( )
①CO2与NaOH溶液 ②NaHCO3溶液与盐酸 ③Na与氧气 ④C与O2 ⑤AlCl3溶液与氨水.
①CO2与NaOH溶液 ②NaHCO3溶液与盐酸 ③Na与氧气 ④C与O2 ⑤AlCl3溶液与氨水.
| A. | 除③外 | B. | 除①④外 | C. | 除②③⑤外 | D. | 除②外 |
14.下列有关说法不正确的是( )
| A. | 物质的量表示含有一定数目粒子的集合体 | |
| B. | 物质的量是联系微观粒子和宏观物质的物理量 | |
| C. | 0.012kg 12C中所含碳原子数约为6.02×1023 | |
| D. | 物质的量可用于表示宏观物质的多少 |
1.下列溶液中溶质物质的量浓度为0.1mol•L-1的是( )
| A. | 将4.0gNaOH溶解于1L水中配成NaOH溶液 | |
| B. | 将6.2gNa2O溶于水并配成2L溶液 | |
| C. | 将0.5mol•L-1NaNO3溶液100mL加热蒸发掉50g水后的溶液 | |
| D. | 1L含K+为0.1mol的K2SO4溶液 |
11.在H、O、C、Na四种元素中,选择适当的元素组成符合如表要求的物质,将它们的化学式填写在空格中.
| 酸性氧化物 | 碱性氧化物 | 酸 | 碱 | 正盐 | 酸式盐 |
| CO2 | Na2O | H2CO3 | NaOH | Na2CO3 | NaHCO3 |
18.下列表示对应的化学反应的离子方程式正确的是( )
| A. | FeO溶于稀硝酸:FeO+2H++NO3-=Fe3++NO↑+H2O | |
| B. | 氯化氢气体通入澄清石灰水中:HCl+OH-=H2O+Cl- | |
| C. | 向Ba(OH)2溶液中滴加NaHSO4溶液至恰好为中性:2Ba2++OH-+H++2SO42-=2BaSO4↓+H2O | |
| D. | 在溶液中,氯化铝与烧碱按物质的量之比1:1混合:Al3++3OH-=Al(OH)3↓ |
15.下列表示物质或微粒的化学用语或模型正确的是( )
| A. | 氮气分子的结构式:N-N | B. | Mg2+的结构示意图: | ||
| C. | 乙醇的结构简式:CH3CH2OH | D. | 二氧化碳电子: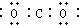 |
16.下列说法中正确的是( )
| A. | 10 L 0.05mol•L-1Ba(OH)2溶液与10 L 0.05mol•L-1 H2SO4反应时的反应热是中和热 | |
| B. | 由2H2(g)+O2(g)=2H2O(l)△H=-571.6 kJ•mol-1知,该反应的反应热为571.6 kJ•mol-1 | |
| C. | 由2H2(l)+O2(l)=2H2O(g)△H=-482.6 kJ•mol-1知,H2的燃烧热为482.6 kJ•mol-1 | |
| D. | 由C3H8(g)+5O2(g)=3CO2(g)+4H2O(l)△H=-2221.5 kJ•mol-1知,气体C3H8的燃烧热为2221.5 kJ•mol-1 |