题目内容
1.下列溶液中溶质物质的量浓度为0.1mol•L-1的是( )| A. | 将4.0gNaOH溶解于1L水中配成NaOH溶液 | |
| B. | 将6.2gNa2O溶于水并配成2L溶液 | |
| C. | 将0.5mol•L-1NaNO3溶液100mL加热蒸发掉50g水后的溶液 | |
| D. | 1L含K+为0.1mol的K2SO4溶液 |
分析 根据n=$\frac{m}{M}$计算物质的量,结合c=$\frac{n}{V}$计算浓度,注意溶液的体积、溶剂的体积以及物质的构成特点,以此解答.
解答 解:A.4.0gNaOH为0.1mol,但1L水的体积不等于溶液的体积,浓度应小于0.1mol/L,故A错误;
B.Na2O溶于水生成NaOH,n(Na2O)=$\frac{6.2g}{62g/mol}$=0.1mol,则生成0.2molNaOH,溶于水并配成2L溶液,浓度为0.1mol/L,故B正确;
C.将0.5mol•L-1NaNO3溶液100mL加热蒸发掉50g水,溶液密度发生变化,体积不等于50mL,故C错误;
D.1L含K+为0.1mol的K2SO4溶液,K2SO4浓度为0.05mol/L,故D错误.
故选B.
点评 本题考查物质的量的相关计算,侧重于学生的分析能力和计算能力的考查,难度不大,注意把握离子的浓度=溶质的物质的量浓度×一个溶质电离出的离子个数.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
9.1998年出现的全球温度大幅度升高,产生了显著的“厄尔尼诺”现象,干旱和暴雨灾难危害了许多地区.为了防止气候变暖的进一步恶化,联合国环境保护组织于1998年通过大会要求各国减少工业排放量的气体是( )
| A. | 二氧化硫 | B. | 二氧化碳 | C. | 氮的氧化物 | D. | 氟里昂 |
16.氯气是一种化学性质很活泼的非金属单质,其具有较强的氧化性.下列叙述中不正确的是( )
| A. | 红热的铜丝在氯气里剧烈燃烧,生成棕黄色的烟 | |
| B. | 钠在氯气中燃烧,生成白色的烟 | |
| C. | 氯气能与水反应生成次氯酸和盐酸,久置的氯水最终变为稀盐酸 | |
| D. | 实验室制取氯气时,为了防止污染环境,多余的氯气可用澄清石灰水吸收 |
6.设NA为阿伏加德罗常数的值.下列叙述正确的是( )
| A. | 3 mol NF3与水完全反应生成HNO3和NO,转移电子数为2NA | |
| B. | 4.4 g14CO2含中子数为2.4NA | |
| C. | 标准状况下,2.24 L Cl2通入足量NaOH溶液中,反应转移电子的数目为0.2NA | |
| D. | 常温常压下,1.7 g H2O2中含有的电子数为NA |
10.将质量分数为P%的硫酸与等体积的水混合后得到质量分数为q%的硫酸,则下列关于P、q的关系式正确的是( )
| A. | p<2q | B. | p>2q | C. | p=2q | D. | p≥2q |
11.一种三室微生物燃料电池可用于污水净化、海水淡化,其工作原理如图所示,图中有机废水中有机物可用C6H10O5表示.下列有关说法不正确的是( )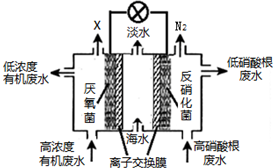

| A. | 中间室Cl-移向左室 | |
| B. | X气体为CO2 | |
| C. | 处理后的含硝酸根废水pH降低 | |
| D. | 电路中每通过4 mol电子,产生标准状况下X的体积为22.4L |

 .
. .
. .
. .
.