题目内容
15.下列表示物质或微粒的化学用语或模型正确的是( )| A. | 氮气分子的结构式:N-N | B. | Mg2+的结构示意图: | ||
| C. | 乙醇的结构简式:CH3CH2OH | D. | 二氧化碳电子: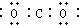 |
分析 A.氮气分子中存在氮氮三键,不是单键;
B.镁离子的核外电子总数为10,最外层为8个电子;
C.乙醇的官能团是羟基;
D.二氧化碳分子中含有两个碳氧双键,碳原子最外层为8个电子.
解答 解:A.氮气分子中含有氮氮三键,氮气的电子式为 ,用短线代替所有共用电子对即为结构式,所以其结构式为N≡N,故A错误;
,用短线代替所有共用电子对即为结构式,所以其结构式为N≡N,故A错误;
B.镁离子的核电荷数为12,最外层为8个电子,镁离子的离子结构示意图为 ,故B错误;
,故B错误;
C.乙醇的结构简式是CH3CH2OH,故C正确;
D.二氧化碳为直线型结构,分子中存在两个碳氧双键,二氧化碳的电子式为 ,故D错误.
,故D错误.
故选C.
点评 本题考查了常见化学用语的判断,题目难度中等,涉及电子式、结构式、离子结构示意图等知识,注意掌握常见化学用语的书写原则,试题侧重考查学生的规范答题能力.

练习册系列答案
相关题目
5.现有如下两个反应:a、NaOH+HCl=NaCl+H2O b、2FeCl3+Fe=3FeCl2
(1)能设计成原电池的是b;
(2)如果不能,说明原因a不是氧化还原反应,没有发生电子的转移;
(3)如果可以,请画出实验装置图,注明选用的电极材料和电解质溶液名称,标出外电路导线中电子流动方向和电流方向(用“$\stackrel{电子}{→}$”、“$\stackrel{电流}{→}$”表示),写出电极反应式.
(1)能设计成原电池的是b;
(2)如果不能,说明原因a不是氧化还原反应,没有发生电子的转移;
(3)如果可以,请画出实验装置图,注明选用的电极材料和电解质溶液名称,标出外电路导线中电子流动方向和电流方向(用“$\stackrel{电子}{→}$”、“$\stackrel{电流}{→}$”表示),写出电极反应式.
| 实验装置图 | 负极反应式:Fe-2e-=Fe2+; 正极反应式:2Fe3++2e-=2Fe2+. |
6.设NA为阿伏加德罗常数的值.下列叙述正确的是( )
| A. | 3 mol NF3与水完全反应生成HNO3和NO,转移电子数为2NA | |
| B. | 4.4 g14CO2含中子数为2.4NA | |
| C. | 标准状况下,2.24 L Cl2通入足量NaOH溶液中,反应转移电子的数目为0.2NA | |
| D. | 常温常压下,1.7 g H2O2中含有的电子数为NA |
3.下列物质中,所含分子数相等的是( )
①4℃时7.2ml水 ②14.7gH2SO4 ③8.4gN2 ④0.3gH2.
①4℃时7.2ml水 ②14.7gH2SO4 ③8.4gN2 ④0.3gH2.
| A. | ①② | B. | ②④ | C. | ①④ | D. | ③④ |
10.将质量分数为P%的硫酸与等体积的水混合后得到质量分数为q%的硫酸,则下列关于P、q的关系式正确的是( )
| A. | p<2q | B. | p>2q | C. | p=2q | D. | p≥2q |
7.下列说法中正确的是( )
①非极性分子中只含有非极性键
②极性分子中只含有极性键
③含有阳离子的晶体一定是离子晶体
④原子晶体中一定含有非极性键
⑤实验测得气态BeCl2为共价分子,两个Be-Cl键间的夹角为180°,由此可判断BeCl2属于非极性分子
⑥CS2在水中的溶解度很小,是由于其属于非极性分子.
①非极性分子中只含有非极性键
②极性分子中只含有极性键
③含有阳离子的晶体一定是离子晶体
④原子晶体中一定含有非极性键
⑤实验测得气态BeCl2为共价分子,两个Be-Cl键间的夹角为180°,由此可判断BeCl2属于非极性分子
⑥CS2在水中的溶解度很小,是由于其属于非极性分子.
| A. | ①②③④ | B. | ③④⑤⑥ | C. | ⑤⑥ | D. | ②④⑤⑥ |
4.NA为阿伏加德罗常数的数值,下列说法正确的是( )
| A. | 7.2g CaO2晶体中阴离子和阳离子总数为0.3NA | |
| B. | 反应3H2(g)+N2(g)?2NH3(g)△H=-92 kJ/mol放出热量9.2kJ时,转移电子0.6NA | |
| C. | 0.1mol/LNH4Cl溶液中Cl-离子数目为0.1NA | |
| D. | 0.1molH2O2分子中含极性共价键数目为0.3NA |
5.下列物质制备的方程式不正确的是( )
| A. | 实验室制氯气:MnO2+2Cl-+4H+$\frac{\underline{\;\;△\;\;}}{\;}$Mn2++Cl2↑+2H2O | |
| B. | 实验室制二氧化硫:Cu+SO42-+4H+$\frac{\underline{\;\;△\;\;}}{\;}$Cu2++SO2↑+2H20 | |
| C. | 实验室用浓氨水与生石灰制氨气:NH3•H20═Ca(OH)2+NH3↑ | |
| D. | 实验室制二氧化氮:Cu+4H++2NO3-═Cu2++2NO2↑+2H20 |