题目内容
氢气是一种清洁能源,也是一种重要的工业原料.
(1)氢气既能与氮气又能与氧气发生反应,但是反应的条件却不相同.
已知:2H2(g)+O2(g)=2H2O (g)△H=-483.6kJ/mol
3H2 (g)+N2(g)?2NH3(g)△H=-92.4kJ/mol
计算断裂1mol N≡N键需要能量 kJ,氮气分子中化学键比氧气分子中的化学键键 (填“强”或“弱”),因此氢气与二者反应的条件不同.
(2)氢气是工业合成氨的原料气,而氨气可用于合成硝酸.已知:N2(g)+O2(g)=2NO (g)△H=+180.8kJ/mol,写出氨气与氧气反应生成一氧化氮和气态水的热化学方程式 .
(3)据报道,科学家在实验室已研制出在燃料电池的反应容器中,利用特殊电极材料以H2
和O2为原料制取过氧化氢的新工艺.原理如图2所示.请写出甲电极的电极反应式 .

(1)氢气既能与氮气又能与氧气发生反应,但是反应的条件却不相同.
已知:2H2(g)+O2(g)=2H2O (g)△H=-483.6kJ/mol
3H2 (g)+N2(g)?2NH3(g)△H=-92.4kJ/mol
计算断裂1mol N≡N键需要能量
(2)氢气是工业合成氨的原料气,而氨气可用于合成硝酸.已知:N2(g)+O2(g)=2NO (g)△H=+180.8kJ/mol,写出氨气与氧气反应生成一氧化氮和气态水的热化学方程式
(3)据报道,科学家在实验室已研制出在燃料电池的反应容器中,利用特殊电极材料以H2
和O2为原料制取过氧化氢的新工艺.原理如图2所示.请写出甲电极的电极反应式

考点:有关反应热的计算,热化学方程式,原电池和电解池的工作原理
专题:
分析:(1)反应物总键能-生成物总键能=反应热,据此计算;键能越大,化学键越强;
(2)根据(1)中的热化学方程式,由盖斯定律构造目标热化学方程式;
(3)燃料电池的负极上是燃料发生失电子的氧化反应,确定正负极,然后确定甲电极作氧化剂,发生还原反应书写电极反应式.
(2)根据(1)中的热化学方程式,由盖斯定律构造目标热化学方程式;
(3)燃料电池的负极上是燃料发生失电子的氧化反应,确定正负极,然后确定甲电极作氧化剂,发生还原反应书写电极反应式.
解答:
解:(1)N≡N键能为x,则3×436kJ/mol+x-2×1173.2kJ/mol=-92.4kJ/mol,解得x=946kJ/mol,故断裂1mol N≡N键需要能量是946kJ,O=O键能是498kJ/mol,故氮气分子中化学键比氧气分子中的化学键强,
故答案为:946;强;
(2)已知:①2H2(g)+O2(g)═2H2O(g)△H=-483.6kJ/mol
②3H2(g)+N2(g)?2NH3(g)△H=-92.4kJ/mol
③N2(g)+O2(g)=2NO(g)△H=+180.8kJ/mol
根据盖斯定律,③×2-②×2+①×3得:4NH3(g)+5O2(g)=4NO(g)+6H2O(g)△H=-904.4kJ/mol,
故答案为:4NH3(g)+5O2(g)=4NO(g)+6H2O(g)△H=-904.4kJ/mol;
(3)由图可知,燃料电池的负极上是燃料发生失电子的氧化反应,燃料电池中H2作还原剂,在负极发生反应,氧气为氧化剂在正极上发生电极反应为2H++O2+2e-=H2O2,
故答案为:2H++O2+2e-=H2O2.
故答案为:946;强;
(2)已知:①2H2(g)+O2(g)═2H2O(g)△H=-483.6kJ/mol
②3H2(g)+N2(g)?2NH3(g)△H=-92.4kJ/mol
③N2(g)+O2(g)=2NO(g)△H=+180.8kJ/mol
根据盖斯定律,③×2-②×2+①×3得:4NH3(g)+5O2(g)=4NO(g)+6H2O(g)△H=-904.4kJ/mol,
故答案为:4NH3(g)+5O2(g)=4NO(g)+6H2O(g)△H=-904.4kJ/mol;
(3)由图可知,燃料电池的负极上是燃料发生失电子的氧化反应,燃料电池中H2作还原剂,在负极发生反应,氧气为氧化剂在正极上发生电极反应为2H++O2+2e-=H2O2,
故答案为:2H++O2+2e-=H2O2.
点评:本题较为综合,涉及化学键键能计算、盖斯定律运用、原电池反应等知识,考查了学生分析问题、解决问题的能力,题目难度中等.注意电极正负极的判断以及反应式的书写,注意燃料电池的负极上是燃料发生失电子的氧化反应.

练习册系列答案
 学练快车道快乐假期寒假作业系列答案
学练快车道快乐假期寒假作业系列答案 新思维寒假作业系列答案
新思维寒假作业系列答案
相关题目
下列对实验现象的解释与结论正确的是( )
| A、除去SO2中少量HCl的方法是:将混合气体通过盛有NaHSO3饱和溶液的洗气瓶 |
| B、用蘸有浓氨水的玻璃棒置于某无机酸浓溶液的试剂瓶口,有大量白烟,说明该无机酸一定为盐酸 |
| C、向铜和稀硫酸的混合物中加入无色溶液,溶液逐渐变成蓝色,铜逐渐溶解,则该无色溶液一定是硝酸 |
| D、向某溶液中加入2滴KSCN溶液,溶液不显红色.再向溶液中加入几滴新制的氯水,溶液变为红色,该溶液中一定含有Fe2+ |
洋蓟属高档蔬菜,从洋蓟提取的物质A具有良好的保健功能和药用价值,A在酸性条件下水解可生成B和C,反应可表示为下列说法不正确的是( )
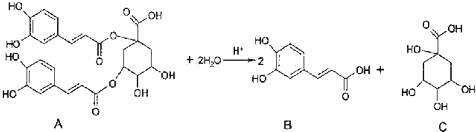

| A、A在一定条件下能发生取代反应、加成反应和消去反应 |
| B、1mol A和足量NaOH溶液反应,最多消耗11molNaOH |
| C、B能和浓溴水发生反应,1mol B最多消耗4 molBr2 |
| D、C分子中含有手性碳原子 |
一定温度下,下列溶液的离子浓度关系式正确的是( )
| A、pH相同的①CH3COONa、②NaHCO3、③NaClO三种溶液的c(Na+):①>②>③ | ||
| B、pH=5的H2S溶液中,c(H+)=c(HS-)=1×10-5 mol?L-1 | ||
| C、pH=a的氨水溶液,稀释10倍后,其pH=b,则a=b+1 | ||
D、pH=2的H2C2O4溶液与pH=12的NaOH溶液任意比例混合:c(Na+)+c(H+)=c(OH-)+c(HC2O
|
 对可逆反应:A(g)+B(g)?2C(g)+D(g)△H<0,根 据图,从a反应历程改变为b反应历程,所采取的措施是( )
对可逆反应:A(g)+B(g)?2C(g)+D(g)△H<0,根 据图,从a反应历程改变为b反应历程,所采取的措施是( )| A、增大b的浓度 | B、升高温度 |
| C、加入催化剂 | D、增大压强 |
下列有关平衡常数叙述中,正确的是( )
| A、不同浓度的同一弱电解质,其电离常数(K)不同 |
| B、温度越高,化学平衡常数一定越大 |
| C、平衡常数发生变化,化学平衡必定发生移动,达到新的平衡 |
| D、化学平衡发生移动,平衡常数必发生变化 |
 ,则乙醇发生消去反应时断裂的键是
,则乙醇发生消去反应时断裂的键是