题目内容
4.下列实验能证明一定有二氧化硫存在的是( )①能使澄清石灰水变浑浊;
②能使湿润的蓝色石蕊试纸变红;
③能使品红溶液褪色;
④通入足量的氢氧化钠溶液再加BaCl2溶液有白色沉淀产生,该沉淀溶于稀盐酸;
⑤通入气体能使溴水褪色,再滴加Ba(NO3)2溶液有白色沉淀产生.
| A. | 只有⑤ | B. | 均能 | C. | ③④⑤ | D. | 均不能 |
分析 ①能使澄清石灰水变浑浊,生成亚硫酸钙沉淀,二氧化碳气体也能使石灰水变浑浊;
②能使湿润的蓝色石蕊试纸变红,但其它酸性溶液都能使蕊试纸变红;
③二氧化硫能使品红溶液褪色,但氯水和其它的强氧化剂的强氧化性也能使品红褪色;
④通入足量的NaOH溶液,再加入BaCl2溶液有白色沉淀产生,该沉淀溶于盐酸,但二氧化碳气体通入足量的NaOH溶液,再加入BaCl2溶液有白色沉淀产生,该沉淀溶于盐酸;
⑤根钡离子结合生成沉淀的只能是硫酸钡,该气体通入溴水发生氧化还原反应,使溴水褪色.
解答 解:①能使澄清石灰水变浑浊,生成亚硫酸钙沉淀,二氧化碳气体也能使石灰水变浑浊,故错误;
②能使湿润的蓝色石蕊试纸变红,但其它酸性溶液都能使蕊试纸变红,故错误;
③二氧化硫能使品红溶液褪色,但氯水和其它的强氧化剂的强氧化性也能使品红褪色,故错误;
④通入足量的NaOH溶液,再加入BaCl2溶液有白色沉淀产生,该沉淀溶于盐酸,但二氧化碳气体通入足量的NaOH溶液,再加入BaCl2溶液有白色沉淀产生,该沉淀溶于盐酸,故错误;
⑤二氧化硫具有还原性,通入溴水能使溴水褪色,同时生成硫酸和氢溴酸,再滴加Ba(NO3)2溶液,生成不溶于硝酸的硫酸钡白色沉淀,故正确;
故选A.
点评 本题考查二氧化硫的化学性质,学生掌握二氧化硫的还原性、酸性氧化物和漂白性,综合性强,比较容易.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
14.在同温同压下,下列各组热化学方程式中,Q1<Q2的是( )
| A. | 2H2(g)+O2(g)→2H2O(l)+Q1 2H2(g)+O2(g)→2H2O(g)+Q2 | |
| B. | S(g)+O2(g)→SO2(g)+Q1 S(s)+O2(g)→SO2(g)+Q2 | |
| C. | C(s)+0.5O2(g)→CO(g)+Q1 C(s)+O2(g)→CO2(g)+Q2 | |
| D. | H2(g)+Cl2(g)→2HCl(g)+Q1 $\frac{1}{2}{H_2}$(g)+$\frac{1}{2}C{l_2}$(g)→HCl(g)+Q2 |
15.用NA表示阿伏加德罗常数的教值,下列说法正确的是( )
| A. | 1Ll.00mol•L-1NaCl溶浓中NaCl分子数为NA | |
| B. | 标准状况下,2.24L由N2和O2组成的混合气体中所含的原子数为0.1NA | |
| C. | 常温下,0.1molCl2溶于水时,转移的电子效是0.1NA | |
| D. | 0.lmolFe与过量稀HNO3反应时,转移的电子教为0.3NA |
12.下列有关化学用语表达正确的是( )
| A. | 35Cl-和37Cl-离子结构示意图均可以表示为: | |
| B. | HClO的结构式:H-Cl-O | |
| C. | HF的电子式: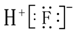 | |
| D. | 质子数为92、中子数为146的U原子:14692U |
19.下列有关化学用语使用正确的是( )
| A. | NH4Br的电子式: | |
| B. | S2-的结构示意图: | |
| C. | 氦气的结构式:He-He | |
| D. | 原子核内有l7个中子的氯原子:${\;}_{17}^{35}$Cl |
9.下列说法正确的是( )
| A. | 地下钢管连接锌板属于牺牲阳极的阴极保护法 | |
| B. | 放热反应的反应速率总是大于吸热反应的反应速率 | |
| C. | 化学平衡发生移动,平衡常数一定发生改变 | |
| D. | 强电解质溶液导电能力一定很强,弱电解质溶液导电能力一定很弱 |
16.如图所示的实验装置不能完成实验目的是( )


| A. | 图1为证明非金属性强弱:Cl>C>Si | |
| B. | 图2为制备少量CO2并控制反应 | |
| C. | 图3为制备并收集少量NO气体 | |
| D. | 图4量取0.10mol•L-1 KOH溶液20.00mL |
14.浓度为0.1mol/L的醋酸溶液用水稀释后,下列说法错误的是( )
| A. | 醋酸的电离度增大 | B. | H+数目增多 | ||
| C. | c(H+)增大 | D. | 导电性减弱 |
 .
. .
.