题目内容
10.常温下,下列各组离子在指定溶液中可能大量共存的是( )| A. | 含有大量ClO-的溶液中:K+、Na+、I ?、SO32? | |
| B. | 使pH试纸变深蓝色的溶液中:NH4+、Na+、SO42?、Cl- | |
| C. | 在c(H+)=1.0×10-13mol•L-1的溶液中:Na+、SO42-、AlO2-、K+ | |
| D. | c(Al3+)=0.1 mol•L-1的溶液中:Na+、NH4+、AlO2?、SO42? |
分析 A.ClO-具有强氧化性;
B.使pH试纸变深蓝色的溶液呈碱性;
C.c(H+)=1.0×10-13mol•L-1的溶液呈碱性;
D.与Al3+反应的离子不能大量共存.
解答 解:A.ClO-具有强氧化性,具有还原性的I ?、SO32?不能大量共存,故A错误;
B.使pH试纸变深蓝色的溶液呈碱性,碱性条件下NH4+不能大量共存,故B错误;
C.c(H+)=1.0×10-13mol•L-1的溶液呈碱性,碱性条件下离子之间不发生任何反应,可大量共存,故C正确;
D.AlO2?与Al3+发生互促水解反应而不能大量共存,故D错误.
故选C.
点评 本题考查离子的共存,为高频考点,把握习题中的信息及离子之间的反应为解答的关键,侧重复分解反应、氧化还原反应的离子共存考查,注意选项D为解答的易错点,题目难度不大.

练习册系列答案
相关题目
16.现有下列十种物质:①H2 ②铝 ③CaO ④CO2 ⑤H2SO4 ⑥Ba(OH)2 ⑦红褐色的氢氧化铁液体 ⑧氨水 ⑨稀硝酸 ⑩Al2(SO4)3
(1)上述各物质按物质的分类方法填写表格的空白处(填物质编号):
(2)⑩在水中的电离方程式为Al2(SO4)3=2Al3++2SO42-.
(3)少量的④通入⑥的溶液中反应的离子方程式为CO2+Ba2++2OH-=BaCO3↓+H2O
(4)②与⑨发生反应的化学方程式为:Al+4HNO3═Al(NO3)3+NO↑+2H2O,该反应的氧化剂是HNO3(填化学式),氧化剂与还原剂的物质的量之比是1:1,当有5.4g Al发生反应时,转移电子的物质的量为0.6.
(1)上述各物质按物质的分类方法填写表格的空白处(填物质编号):
| 分类标准 | 金属单质 | 氧化物 | 溶液 | 胶体 | 电解质 |
| 属于该类的物质 |
(3)少量的④通入⑥的溶液中反应的离子方程式为CO2+Ba2++2OH-=BaCO3↓+H2O
(4)②与⑨发生反应的化学方程式为:Al+4HNO3═Al(NO3)3+NO↑+2H2O,该反应的氧化剂是HNO3(填化学式),氧化剂与还原剂的物质的量之比是1:1,当有5.4g Al发生反应时,转移电子的物质的量为0.6.
16.下列叙述不正确的是( )
| A. | 液态氯化氢不导电,说明它是共价化合物 | |
| B. | 若电解质溶液中分子和离子同时存在,电离方程中只能采用“?”表示 | |
| C. | 相同条件下,强电解质溶液的导电性一定比弱电解质溶液强 | |
| D. | 物质导电的本质是存在自由移动的离子 |
15.下列溶液中微粒的物质的量浓度关系一定正确的是( )
| A. | 0.1mol/L NH4Cl溶液与0.05mol/L NaOH溶液等体积混合后所得的碱性溶液中:c(Cl-)>c(Na+)>c(NH${\;}_{4}^{+}$)>c(OH-)>c(H+) | |
| B. | pH=2的HA溶液与pH=12的MOH溶液等体积混合:c(M+)=c(A-)>c(OH-)=c(H+) | |
| C. | 等物质的量的NaClO、NaHCO5混合溶液中:c(HClO)+c(ClO-)═c(HCO3-)+c(H2CO3)+c(CO32-) | |
| D. | 某二元弱酸的酸式盐NaHA溶液:c(Na+)+c(H+)=c(OH-)+c(HA-)+c(A2-) |
19.相同温度下等物质的量浓度的下列溶液中,pH值最大的是 ( )
| A. | NH4Cl | B. | NH3.H2O | C. | NH4HSO4 | D. | (NH4)2SO4 |
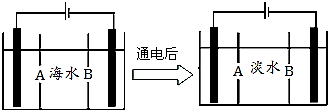 南海某小岛上,可利用的淡水资源相当匮乏,解放军战士为了寻找合适的饮用水源,对岛上山泉水进行分析化验,结果显示山泉水属于硬水.
南海某小岛上,可利用的淡水资源相当匮乏,解放军战士为了寻找合适的饮用水源,对岛上山泉水进行分析化验,结果显示山泉水属于硬水.