题目内容
11.正丁醛是一种化工原料.某实验小组利用如下装置合成正丁醛.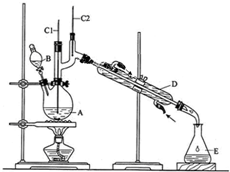
发生的反应如下:CH3CH2CH2CH2OH$→_{H_{2}SO_{4}/△}^{Na_{2}Cr_{2}O_{7}}$CH3CH2CH2CHO
反应物和产物的相关数据列表如下:
| 沸点/℃ | 密度/g•cm-3 | 水中溶解性 | |
| 正丁醇 | 117.2 | 0.8109 | 微溶 |
| 正丁醛 | 75.7 | 0.8017 | 微溶 |
将6.0gNa2Cr2O7放入100mL烧杯中,加30mL水溶解,再缓慢加入5mL浓硫酸,将所得溶液小心转移至B中.在A中加入4.0g正丁醇和几粒沸石,加热.当有蒸汽出现时,开始滴加B中溶液.滴加过程中保持反应温度为90~95℃,在E中收集90℃以上的馏分.将馏出物倒入分液漏斗中,分去水层,有机层干燥后蒸馏,收集75~77℃馏分,产量2.0g.回答下列问题:
(1)实验中,能否将Na2Cr2O7溶液加到浓硫酸中,说明理由不能,易迸溅.
(2)加入沸石的作用是防止暴沸.
(3)上述装置图中,B仪器的名称是分液漏斗,D仪器的名称是冷凝管.
(4)分液漏斗使用前必须进行的操作是c(填正确答案标号).
a.润湿 b.干燥 c.检漏 d.标定
(5)将正丁醛粗产品置于分液漏斗中分水时,水在下层(填“上”或“下”).
(6)本实验中,纯净的正丁醛的检验方法:利用质谱仪测定相对分子质量.
分析 (1)不能将Na2Cr2O7溶液加到浓硫酸中,因为浓硫酸的密度大,且溶于水时会放出大量的热,容易发生迸溅;
(2)加入沸石的作用是防止暴沸,若加热后发现未加沸石,应该冷却后补加;
(3)B仪器的名称是分液漏斗,D仪器的名称直形冷凝管;
(4)分液漏斗使用前必须进行的第一项操作是检漏;
(5)由表中数据可知,正丁醛密度小于水的密度,据此判断;
(6)质谱仪可测定有机物的相对分子质量.
解答 解:(1)因为浓硫酸的密度大,且溶于水放出大量的热,所以不能将Na2Cr2O7溶液加到浓硫酸中,否则容易发生迸溅,
故答案为:不能,因为浓硫酸的密度大,且溶于水放出大量的热,容易发生迸溅;
(2)加入沸石的作用是防止暴沸,若加热后发现未加沸石,应该冷却后补加,
故答案为:防止暴沸;冷却后补加;
(3)B仪器的名称是滴液漏斗,D仪器的名称直形冷凝管,
故答案为:滴液漏斗;直形冷凝管;
(4)分液漏斗使用前必须进行的第一项操作是检漏,
故答案为:c;
(5)正丁醛密度为0.8017 g•cm-3,小于水的密度,故分层水层在下方,
故答案为:下;
(6)可利用质谱仪测定样品的相对分子质量,如果为72,则可判断样品为纯正丁醛,故答案为:利用质谱仪测定相对分子质量.
点评 本题考查有机化学实验、反应原理、基本操作、化学计算等,难度不大,注意正丁醛与正丁醇的结构和性质差异及利用质谱仪测定相对分子质量,注意对基础知识的理解掌握.

练习册系列答案
 三新快车金牌周周练系列答案
三新快车金牌周周练系列答案
相关题目
3.一氯甲烷(CH3C1)是一种重要的化工原料,常温下它是无色有毒气体,微溶于水,易溶于乙醇、CCl4等.(1)甲组同学在实验室用图1所示装置模拟催化法制备和收集一氯甲烷.
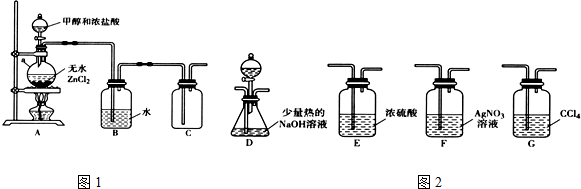
①无水ZnCl2为催化剂,a瓶中发生反应的化学方程式为CH3OH+HCl$→_{△}^{ZnCl_{2}}$CH3Cl+H2O.
②装置B的主要作用是除去氯化氢气体.
③收集到的CH3Cl气体在氧气中充分燃烧,产物用过量的V1mL、c1mol•L-1NaOH溶液充分吸收,以甲基橙作指示剂,用c2 mol•L-1盐酸标准液对吸收液进行返滴定(发生的反应为:
NaOH+HCl=NaCl+H2O,Na2CO3+2HCl=2NaCl+2CO2↑+2H2O),最终消耗V2mL盐酸.则所收集CH3Cl的物质的量为(c1V1-c2V2)×10-3 _ mol.(已知:2CH3Cl+3O2$\stackrel{点燃}{→}$2CO2+2H2O+2HCl)
(2)乙组同学选用甲组A、B装置和图2所示的部分装置检验CH3Cl中的氯元素.
(已知:一卤代烷一般要在加热条件下才能与氢氧化钠溶液反应)
①乙组同学的实验装置中,依次连接的合理顺序为A→B→F→D→G.
②通入一段时间的CH3Cl气体,打开装置D中分液漏斗的活塞,观察实验现象.分液漏斗中盛放的试剂是硝酸和硝酸银溶液.
③能证明CH3Cl中含有氯元素的实验现象是F中无白色沉淀生成,D中有白色沉淀生成.
(3)查阅资料可知:AgNO3的乙醇溶液可以检验CH3X中的卤素原子.相关数据如表:
①CH3X通入AgNO3的乙醇溶液中,除有沉淀生成外,还生成硝酸甲酯,请写出硝酸甲酯的结构简式:CH3ONO2.
③将CH3Cl和CH3Br的混合气体通入AgNO3的乙醇溶液中,先出现淡黄色沉淀.请依据表中数据解释原因C-Br键的键能小,更容易断裂,同时溴化银的溶度积常数更小,溴化银更容易形成沉淀.

①无水ZnCl2为催化剂,a瓶中发生反应的化学方程式为CH3OH+HCl$→_{△}^{ZnCl_{2}}$CH3Cl+H2O.
②装置B的主要作用是除去氯化氢气体.
③收集到的CH3Cl气体在氧气中充分燃烧,产物用过量的V1mL、c1mol•L-1NaOH溶液充分吸收,以甲基橙作指示剂,用c2 mol•L-1盐酸标准液对吸收液进行返滴定(发生的反应为:
NaOH+HCl=NaCl+H2O,Na2CO3+2HCl=2NaCl+2CO2↑+2H2O),最终消耗V2mL盐酸.则所收集CH3Cl的物质的量为(c1V1-c2V2)×10-3 _ mol.(已知:2CH3Cl+3O2$\stackrel{点燃}{→}$2CO2+2H2O+2HCl)
(2)乙组同学选用甲组A、B装置和图2所示的部分装置检验CH3Cl中的氯元素.
(已知:一卤代烷一般要在加热条件下才能与氢氧化钠溶液反应)
①乙组同学的实验装置中,依次连接的合理顺序为A→B→F→D→G.
②通入一段时间的CH3Cl气体,打开装置D中分液漏斗的活塞,观察实验现象.分液漏斗中盛放的试剂是硝酸和硝酸银溶液.
③能证明CH3Cl中含有氯元素的实验现象是F中无白色沉淀生成,D中有白色沉淀生成.
(3)查阅资料可知:AgNO3的乙醇溶液可以检验CH3X中的卤素原子.相关数据如表:
| 化学键 | C-Cl | C-Br |
| 键能(kJ•mol-1) | 330 | 276 |
| 化合物 | AgCl | AgBr |
| Ksp近似值 | 1.8×10-10 | 5×10-13 |
③将CH3Cl和CH3Br的混合气体通入AgNO3的乙醇溶液中,先出现淡黄色沉淀.请依据表中数据解释原因C-Br键的键能小,更容易断裂,同时溴化银的溶度积常数更小,溴化银更容易形成沉淀.
1.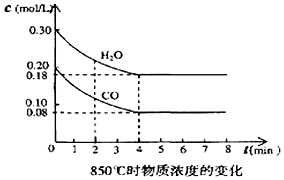 已知:O2(g)+2H2(g)=2H2O(g)△H=-483.6kJ•mol-1
已知:O2(g)+2H2(g)=2H2O(g)△H=-483.6kJ•mol-1
C(s,石墨)+O2(g)=CO2(g)△H=-393.5kJ•mol-1
CO2(g)+C(s,石墨)=2CO(g)△H=+172.5kJ•mol-1
(1)请写出CO与水蒸汽反应的热化学方程式CO(g)+H2O(g)?CO2(g)+H2(g)△H=-41.2kJ•mol-1
(2)在一体积为10L的密闭容器中,通入一定量的CO和水蒸汽,在850℃时发生反应,容器中CO和水蒸汽浓度变化如图,则0~4min的平均反应速率v(CO)=0.03mol/(L•min),请计算此时的平衡常数K=1.
(3)t℃(高于850℃)时,在相同容器中发生上述反应,容器内各物质的浓度变化如右表.
①表中3min~4min之间反应处于平衡状态;c1数值大于0.08mol/L (填大于、小于或等于).
②反应在4min~5min间,平衡向逆方向移动,可能是以下的原因d(填字母),表中5min~6min之间数值发生变化,可能的原因是a.(填字母)
a.增加水蒸气 b.降低温度 c.使用催化剂 d.增加氢气浓度.
 已知:O2(g)+2H2(g)=2H2O(g)△H=-483.6kJ•mol-1
已知:O2(g)+2H2(g)=2H2O(g)△H=-483.6kJ•mol-1C(s,石墨)+O2(g)=CO2(g)△H=-393.5kJ•mol-1
CO2(g)+C(s,石墨)=2CO(g)△H=+172.5kJ•mol-1
(1)请写出CO与水蒸汽反应的热化学方程式CO(g)+H2O(g)?CO2(g)+H2(g)△H=-41.2kJ•mol-1
(2)在一体积为10L的密闭容器中,通入一定量的CO和水蒸汽,在850℃时发生反应,容器中CO和水蒸汽浓度变化如图,则0~4min的平均反应速率v(CO)=0.03mol/(L•min),请计算此时的平衡常数K=1.
| 时间/min | CO | H2O | CO2 | H2 |
| 0 | 0.200 | 0.300 | 0 | 0 |
| 2 | 0.138 | 0.238 | 0.062 | 0.062 |
| 3 | c1 | c2 | c3 | c3 |
| 4 | c1 | c2 | c3 | c3 |
| 5 | 0.116 | 0.216 | 0.084 | |
| 6 | 0.096 | 0.266 | 0.104 |
①表中3min~4min之间反应处于平衡状态;c1数值大于0.08mol/L (填大于、小于或等于).
②反应在4min~5min间,平衡向逆方向移动,可能是以下的原因d(填字母),表中5min~6min之间数值发生变化,可能的原因是a.(填字母)
a.增加水蒸气 b.降低温度 c.使用催化剂 d.增加氢气浓度.

 .
.