题目内容
15.设NA代表阿伏加德罗常数的数值,下列有关说法正确的是( )| A. | 1mol乙烷含C-H键的数目为7NA | |
| B. | 1L0.5mol/LNa2S溶液中HS-的数目为0.5NA | |
| C. | 标准状况下,Na与水反应产生22.4 LH2时转移电子数目为2 NA | |
| D. | 含1mol HCOOH的水溶液中含氧原子的总数目为2NA |
分析 A.1mol乙烷含6molC-H键;
B.HS-易水解;
C.反应生成1mol氢气需要2mol电子;
D.除了甲酸含有氧原子,水也含氧原子.
解答 解:A.1mol乙烷含6molC-H键,含C-H键的数目为6NA,故A错误;
B.硫离子部分水解,HS-数目小于0.5NA,故B错误;
C.反应生成1mol氢气需要2mol电子,Na与水反应产生22.4 LH2时转移电子数目为2 NA,故C正确;
D.除了甲酸含有氧原子,水也含氧原子,故溶液中所含的氧原子的物质的量大于2mol,即大于2NA个,故D错误.
故选C.
点评 本题考查了阿伏伽德罗常数的有关计算,熟练掌握公式的使用和物质的结构是解题关键,难度不大.

练习册系列答案
相关题目
1.镁电池放电时电压高而平稳,镁电池成为人们研制的绿色电池,一种镁电池的反应式为xMg+Mo3S4$?_{充电}^{放电}$MgxMo3S4,下列说法中正确的是( )
| A. | 充电时MgxMo3S4只发生还原反应 | |
| B. | 放电时Mo3S4只发生氧化反应 | |
| C. | 充电时阳极反应式为 Mo3S42x--2xe-=Mo3S4 | |
| D. | 放电时负极反应式为xMg=xMg2+-2xe- |
3.氧元素和硫元素的本质区别是( )
| A. | 中子数不同 | B. | 质子数不同 | ||
| C. | 电子数不同 | D. | 相对原子质量不同 |
10.图是周期表的一部分,A、B、C、D、
4种元素的原子核外共含有48个质子,A、B、C为第三周期元素.
(1)B、C、D的元素符号分别是:BSi,CP,DC
(2)写出A离子的结构示意图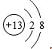
(3)E位于元素周期表的第四周期、第IVA族
(4)B元素属于非金属元素(填“金属”或“非金属”),A元素最高价氧化物属于两性氧化物(填“碱性”、“酸性”或“两性”)
| D | ||
| A | B | C |
| E |
(1)B、C、D的元素符号分别是:BSi,CP,DC
(2)写出A离子的结构示意图
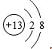
(3)E位于元素周期表的第四周期、第IVA族
(4)B元素属于非金属元素(填“金属”或“非金属”),A元素最高价氧化物属于两性氧化物(填“碱性”、“酸性”或“两性”)
7.若温度不变,滴入稀盐酸使溶液中的c(H+)=5.0×10-4mol•L-1,则此时溶液中的c(OH-)为8.0×10-11mol•L-1,由水电离出的c(H+)为8.0×10-11mol•L-1.
5.下列说法正确的是( )
| A. | 塑料、橡胶、合成纤维、酚醛树脂都属于有机高分子化合物 | |
| B. | 鸡蛋清中加入Na2SO4、CuSO4都会因盐析产生沉淀 | |
| C. | 油脂的皂化反应生成高级脂肪酸和丙醇 | |
| D. | 通过石油催化重整是获得烯烃的主要途径 |