题目内容
19.下列有关实验现象的描述不正确的是( )| A. | 把铜片和铁片紧靠在一起浸入稀H2SO4中,铜片表面出现气泡 | |
| B. | 把铁钉和碳棒用铜线连接后,浸入0.1 mol•L-1的食盐溶液中,铁钉作负极被腐蚀 | |
| C. | 把铜片插入氯化铁溶液中,在铜片表面出现一层铁 | |
| D. | 把锌粒放入盛有盐酸的试管中,加入几滴氯化铜溶液,气泡放出速率加快 |
分析 A.铜片和铁片和稀硫酸构成原电池,铜作正极;
B.铁钉和碳棒用铜线连接后,浸入0.1 mol•L-1的食盐溶液中,铁钉作负极发生吸氧腐蚀;
C.铜不能与氯化铁反应生成铁,据此解答即可;
D.构成原电池反应,可以加速反应的速率.
解答 解:A.把铜片和铁片紧靠在一起浸入稀硫酸中,形成铜、铁、稀硫酸原电池,正极是金属铜,该极上电子和溶液中的氢离子结合产生氢气,故A正确;
B.铁钉和碳棒用铜线连接后,浸入0.1 mol•L-1的食盐溶液中,铁钉作负极发生吸氧腐蚀,故B正确;
C.把铜片插入三氯化铁溶液中,铜和氯化铁反应生成氯化铜和氯化亚铁,不能生成铁单质,故C错误;
D.把锌片放入盛盐酸的试管中,加入几滴氯化铜溶液,锌置换出铜,所以形成了铜、锌、稀盐酸原电池,原电池反应可以加速反应的速率,故D正确;
故选C.
点评 本题主要考查了原电池的有关应用,解答须理解原电池的构成条件及反应原理,题目难度适中.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
9.通过α粒子轰击金箔的实验现象,否定葡萄干面包原子模型,提出新的原子结构模型的科学家是( )
| A. | 汤姆孙 | B. | 伦琴 | C. | 道尔顿 | D. | 卢瑟福 |
7.下列说法正确的是( )
| A. | 石蜡油分解产生的气态产物中不含有不饱和烃 | |
| B. | 甲烷、乙烯和苯在工业上都可通过石油分馏得到 | |
| C. | 油脂是种高级脂肪酸甘油酯,其中植物油通过氢化可以变成脂肪 | |
| D. | 苯与浓硝酸、浓硫酸混合,加强热以制备硝基苯 |
11.下列说法正确的是( )
| A. | 水晶项链和餐桌上的瓷盘都是硅酸盐制品 | |
| B. | 工艺师利用盐酸刻蚀石英制作艺术品 | |
| C. | 硅是人类将太阳能转换为电能的常用材料 | |
| D. | 由粗硅制备单晶硅不涉及氧化还原 |
8.下列说法不正确的是( )
| A. | 分液时,分液漏斗下层液体从下口放出,上层液体从上口倒出 | |
| B. | 蒸馏时,应使温度计水银球靠近蒸馏烧瓶支管口下沿处 | |
| C. | 蒸发结晶时应将溶液蒸干 | |
| D. | 能用CCl4从碘水中萃取碘是由于CCl4与H2O互不相溶且碘在CCl4中溶解度比在水中的大 |
20.下列叙述正确的是( )
| A. | Fe 与S混合加热生成FeS | |
| B. | Fe与Cl2反应生成FeCl2 | |
| C. | 过量的铜与浓硝酸反应有一氧化氮生成 | |
| D. | 氯气具有漂白性 |
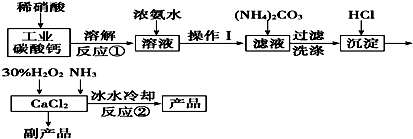
 硼及其化合物在工业上有许多用途.工业上以铁硼矿为原料制备硼酸,铁硼矿含有Mg、Fe、Ca、Al、B、O等多种元素,它的主要成分为Mg2B2O5•H2O和Fe3O4.
硼及其化合物在工业上有许多用途.工业上以铁硼矿为原料制备硼酸,铁硼矿含有Mg、Fe、Ca、Al、B、O等多种元素,它的主要成分为Mg2B2O5•H2O和Fe3O4.