题目内容
下列离子方程式正确的是( )
| A、水玻璃长时间放置在空气中:SiO32-+CO2+H2O═H2SiO3↓+HCO3- | ||||
| B、硫酸铜溶液显酸性:Cu2++2H2O═Cu(OH)2↓+2H+ | ||||
C、用石墨电极电解饱和食盐水:2H++2Cl-
| ||||
| D、向明矾溶液中滴加Ba(OH)2溶液,恰好使SO42-沉淀完全:Al3++2SO42-+2Ba2++4OH-═AlO2-+2BaSO4↓+2H2O |
考点:离子方程式的书写
专题:离子反应专题
分析:A.反应生成硅酸和碳酸氢钠,电荷不守恒;
B.水解为可逆反应,且不生成沉淀;
C.石墨电极电解饱和食盐水,水中的氢离子放电,氯离子放电;
D.恰好使SO42-沉淀完全,二者反应生成硫酸钡和偏铝酸钾.
B.水解为可逆反应,且不生成沉淀;
C.石墨电极电解饱和食盐水,水中的氢离子放电,氯离子放电;
D.恰好使SO42-沉淀完全,二者反应生成硫酸钡和偏铝酸钾.
解答:
解:A.水玻璃长时间放置在空气中的离子反应为SiO32-+2CO2+2H2O═H2SiO3↓+2HCO3-,故A错误;
B.硫酸铜溶液显酸性是因Cu2++2H2O?Cu(OH)2+2H+,故B错误;
C.用石墨电极电解饱和食盐水的离子反应为2H2O+2Cl-
H2↑+Cl2↑+2OH-,故C错误;
D.向明矾溶液中滴加Ba(OH)2溶液,恰好使SO42-沉淀完全的离子反应为Al3++2SO42-+2Ba2++4OH-═AlO2-+2BaSO4↓+2H2O,故D正确;
故选D.
B.硫酸铜溶液显酸性是因Cu2++2H2O?Cu(OH)2+2H+,故B错误;
C.用石墨电极电解饱和食盐水的离子反应为2H2O+2Cl-
| ||
D.向明矾溶液中滴加Ba(OH)2溶液,恰好使SO42-沉淀完全的离子反应为Al3++2SO42-+2Ba2++4OH-═AlO2-+2BaSO4↓+2H2O,故D正确;
故选D.
点评:本题考查离子反应方程式书写的正误判断,为高频考点,把握发生的化学反应为解答的关键,侧重复分解反应、水解反应、电解反应及与量有关的离子反应考查,注重分析能力与知识综合应用能力的训练,题目难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
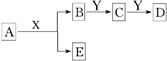 中学化学中,常见无机物A、B、C、D、E、X、Y存在如下图转化关系(部分生成物和反应条件略去).下列推断正确的是( )
中学化学中,常见无机物A、B、C、D、E、X、Y存在如下图转化关系(部分生成物和反应条件略去).下列推断正确的是( )| A、若A是CaC2,X是H2O,则Y一定是溴水 |
| B、若A是金属钠,X是H2O,则E一定能还原Fe2O3 |
| C、若Y是NaOH,C是白色沉淀,则A与X一定发生置换反应 |
| D、若Y是氧气,D是氧化物,则A与X一定发生氧化还原反应 |
短周期元素W、X、Y、Z的原子序数依次增大,且原子最外层电子数之和为14.W的原子半径比X的大,X原子的最外层电子数是内层电子数的2倍,元素Y是地壳中含量最高的金属元素,Z原子的最外层电子数是其电子层数的2倍.下列说法正确的是( )
| A、元素X的最高价氧化物对应的水化物的酸性比Z的弱 |
| B、元素Y、Z的简单离子的电子层结构相同 |
| C、元素W与Z形成的化合物为共价化合物 |
| D、原子半径由大到小的顺序为:r(Z)>r(Y)>r (W) |
“阿波罗号飞船”所用的氢氧燃料电池的电极反应为:
负极:2H2+4OH--4e-=4H2O
正极 O2+2H2O+4e-=4OH-
该电池工作时,下列叙述正确的是( )
负极:2H2+4OH--4e-=4H2O
正极 O2+2H2O+4e-=4OH-
该电池工作时,下列叙述正确的是( )
| A、氢气发生还原反应 |
| B、每转移4摩电子,电池内增加4mol水 |
| C、负极附近溶液的PH值降低 |
| D、正极附近C(H+)增大 |
下列关于盐类水解的叙述中,错误的是( )
| A、盐类水解是中和反应的逆反应 |
| B、盐类水解过程是吸热过程 |
| C、含有弱酸根盐的水溶液一定显碱性 |
| D、盐溶液的酸碱性主要决定于形成盐的酸和碱的相对强弱 |
将相对分子质量为M 的某气体VL(标准状况下)溶于10mL水中,所得溶液密度为d g/mL,则此溶液的物质的量浓度为( mol/L)( )
A、
| ||
B、
| ||
C、
| ||
D、
|
 用1.0mol/L的NaOH溶液中和某浓度的H2SO4溶液,其水溶液的pH和所用NaOH溶液的体积关系变化如图所示,则原H2SO4溶液的物质的量浓度和完全反应后溶液的大致体积是( )
用1.0mol/L的NaOH溶液中和某浓度的H2SO4溶液,其水溶液的pH和所用NaOH溶液的体积关系变化如图所示,则原H2SO4溶液的物质的量浓度和完全反应后溶液的大致体积是( )| A、1.0mol/L,20mL |
| B、0.5mol/L,40mL |
| C、0.5mol/L,80mL |
| D、1.0mol/L,80mL |
 氮是地球上含量丰富的一种元素,氮及其化合物在工农业生产、生活中有着重要作用.请回答:
氮是地球上含量丰富的一种元素,氮及其化合物在工农业生产、生活中有着重要作用.请回答: