题目内容
13.短周期金属元素甲-戊在元素周期表中的相对位置如表所示,下面判断正确的是( )| 甲 | 乙 | |
| 丙 | 丁 | 戊 |
| A. | 原子半径:戊<丁<丙 | |
| B. | 金属性:甲>丙 | |
| C. | 最高价氧化物水化物碱性:丙>丁>戊 | |
| D. | 最外层电子数:甲>乙 |
分析 根据各元素在周期表中的相对位置可知:甲为Li、丙为Na、乙为Be、丁为Mg、戊为Al,
A.同周期自左而右原子半径减小、电子层越多原子半径越大;
B.同主族元素中,原子序数越大,金属性越强;
C.同周期从左向右金属性减弱,同主族从上向下,金属性增强,金属性越强,对应的最高价氧化物的水化物的碱性越强;
D.同一周期,原子序数越大,最外层电子数越多.
解答 解:根据各元素在周期表中的相对位置可知:甲为Li、丙为Na、乙为Be、丁为Mg、戊为Al,
A.同周期自左而右原子半径逐渐减小,则原子半径大小为:戊<丁<丙,故A正确;
B.同主族从上到下元素的金属性在增强,则金属性为甲<丙,故B错误;
C.Na、Mg、Al同周期,自左而右金属性减弱,故金属性Na>Ma>Al,最高价氧化物对应的水化物碱性:Na>Mg>Al,故C正确;
D.甲为Li、乙为Be,最外层含有电子数分别为1、2,最外层电子数:甲<乙,故D错误;
故选AC.
点评 本题考查位置、结构与性质关系及应用,题目难度不大,侧重对基础知识的巩固,注意掌握元素周期表的结构、元素周期律内容,试题有利于提高学生的逻辑推理能力.

练习册系列答案
相关题目
3.下列微粒中:①13Al3+② ③
③ ④F-,其核外电子数相同的是( )
④F-,其核外电子数相同的是( )
 ③
③ ④F-,其核外电子数相同的是( )
④F-,其核外电子数相同的是( )| A. | ①②③ | B. | ②③④ | C. | ①②④ | D. | ①③④ |
4.下列互为同位素的是( )
| A. | Na 和 Na+ | B. | H2和 D2 | C. | 16O 和 18O | D. | CO 和 CO2 |
1.下列物质的分类合理的是( )
| A. | 酸性氧化物:CO2、SiO2、SO2、NO2 | |
| B. | 碱:NaOH、KOH、Ba(OH)2、纯碱 | |
| C. | 混合物:盐酸 漂白粉 水煤气 氢氧化铁胶体 | |
| D. | 碱性氧化物:Na2O2、CaO、MgO、Al2O3 |
8.下列关于卤族元素(X)及其化合物叙述错误的是( )
| A. | 单质均有颜色,随原子序数递增颜色加深 | |
| B. | HX随原子序数递增稳定性逐渐减弱 | |
| C. | 单质(除F2)均能与水反应形成HX和HXO,HXO的结构式为:H-X-O | |
| D. | HX中除HF分子间存在氢键,其余HX分子均不存在氢键 |
18.下列物质一定属于同系物的是( )
①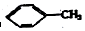 ②
②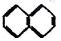 ③
③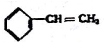 ④C2H4 ⑤CH2=CH-CH=CH2 ⑥C2H6 ⑦
④C2H4 ⑤CH2=CH-CH=CH2 ⑥C2H6 ⑦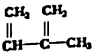 ⑧
⑧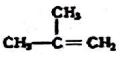
①
 ②
② ③
③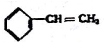 ④C2H4 ⑤CH2=CH-CH=CH2 ⑥C2H6 ⑦
④C2H4 ⑤CH2=CH-CH=CH2 ⑥C2H6 ⑦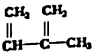 ⑧
⑧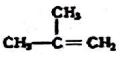
| A. | ④和⑧ | B. | ①、②和③ | C. | ⑤、⑦和⑧ | D. | ⑥和⑧ |
5.某化学研究性学习小组模拟工业生产流程制备无水氯化铁并对产物做如下探究实验.

已知:①无水氯化铁在空气中易潮解,加热易升华;②工业上,向500-600℃的铁屑中通入氯气和生产无水氯化铁;③向炽热的铁屑中通入氯化氢可以生成无水氯化亚铁和氢气.
(1)仪器N的名称是分液漏斗,N中盛有浓盐酸,烧瓶M中的固体试剂KMnO4(或KClO3)(填化学式).
(2)装置的连接顺序为a→g→h→d→e→b→c→d→e→f.(用小写字母表示,部分装置可重复使用)
(3)若缺少装置E、则对本实验造成的影响是HCl和Fe反应生成的H2与Cl2混合受热发生爆炸,且有杂质氯化亚铁生成;请简述检验产物是否受影响的方法及实验现象:取少量产物于一洁净的试管种加少量水将产物溶解,向其中滴加铁氰化钾溶液,若产生蓝色沉淀,则证明存在氯化亚铁.
(4)已知硫代硫酸钠(Na2S2O3)溶液在工业上可作脱氧剂,反应后Na2S2O3被氧化为Na2SO4,则装置D中发生反应的离子方程式为S2O32-+4Cl2+5H2O=2SO42-+8Cl-+10H+
(5)实验结束并冷却后,将硬质玻璃管及收集器中的物质一并快速转移至锥形瓶中,加入过量的稀盐酸和少许植物油(反应过程中不振荡),充分反应后,进行如下实验:
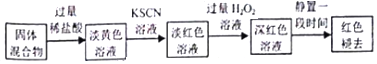
①淡红色溶液中加入过量H2O2溶液后,溶液红色加深的原因是2Fe2++2H++H2O2=2F3++2H2O(用离子方程式表示).
②已知红色褪去的同时有气体产生,经检验气体为O2,该小组对红色褪去的原因进行探究.
由实验Ⅰ和Ⅱ可得出的结论为H2O2将SCN-氧化成SO42-.

已知:①无水氯化铁在空气中易潮解,加热易升华;②工业上,向500-600℃的铁屑中通入氯气和生产无水氯化铁;③向炽热的铁屑中通入氯化氢可以生成无水氯化亚铁和氢气.
(1)仪器N的名称是分液漏斗,N中盛有浓盐酸,烧瓶M中的固体试剂KMnO4(或KClO3)(填化学式).
(2)装置的连接顺序为a→g→h→d→e→b→c→d→e→f.(用小写字母表示,部分装置可重复使用)
(3)若缺少装置E、则对本实验造成的影响是HCl和Fe反应生成的H2与Cl2混合受热发生爆炸,且有杂质氯化亚铁生成;请简述检验产物是否受影响的方法及实验现象:取少量产物于一洁净的试管种加少量水将产物溶解,向其中滴加铁氰化钾溶液,若产生蓝色沉淀,则证明存在氯化亚铁.
(4)已知硫代硫酸钠(Na2S2O3)溶液在工业上可作脱氧剂,反应后Na2S2O3被氧化为Na2SO4,则装置D中发生反应的离子方程式为S2O32-+4Cl2+5H2O=2SO42-+8Cl-+10H+
(5)实验结束并冷却后,将硬质玻璃管及收集器中的物质一并快速转移至锥形瓶中,加入过量的稀盐酸和少许植物油(反应过程中不振荡),充分反应后,进行如下实验:

①淡红色溶液中加入过量H2O2溶液后,溶液红色加深的原因是2Fe2++2H++H2O2=2F3++2H2O(用离子方程式表示).
②已知红色褪去的同时有气体产生,经检验气体为O2,该小组对红色褪去的原因进行探究.
| 实验 | 操作 | 现象 | |
| 实验Ⅰ (取褪色后溶液3等份) | 第1份 | 滴加FeCl2溶液 | 无明显变化 |
| 第2份 | 滴加KSCN溶液 | 溶液出现红色 | |
| 第3份 | 滴加稀盐酸和BaCl2溶液 | 产生白色沉淀 | |
| 实验Ⅱ (取与褪色后的溶液同浓度的FeCl3溶液) | 滴加2滴KSCN溶液,溶液变红,再通入O2 | 无明显变化 | |