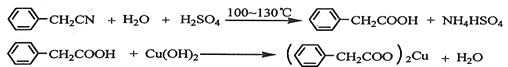
题目内容
10.在一定温度下,将4mol SO2与2mol O2放入4L的密闭容器中,在一定条件下反应,2SO2+O2?2SO3.10min 时达到平衡状态.此时容器内压强比反应前减少20%,计算SO2的转化率为60%.分析 此时容器内压强比反应前减少20%,可知物质的量减少20%,假设达到平衡时消耗2molSO2,则
2SO2+O2?2SO3
起始(mol) 4 2 0
转化(mol) x 0.5x x
平衡(mol) 4-x 2-0.5x x
结合容器内压强比反应前减少20%计算该题.
解答 解:此时容器内压强比反应前减少20%,可知物质的量减少20%,假设达到平衡时消耗2molSO2,则
2SO2+O2?2SO3
起始(mol) 4 2 0
转化(mol) x 0.5x x
平衡(mol) 4-x 2-0.5x x
则(4+2)×(1-20%)=(4-x+2-0.5x+x),
x=2.4,
则转化率为$\frac{2.4}{6}×100%$=60%,
故答案为:60%.
点评 本题考查化学平衡的有关计算,为高频考点,侧重于学生的分析、计算能力的考查,本题可用三段式法,也可用差量法计算参加反应的SO2的物质的量,生成的SO3的物质的量,简化计算,注意优化解题方法.

练习册系列答案
相关题目
10.在溶液中加入足量Na2O2后仍能大量共存的离子组是( )
| A. | NH4+、Ba2+、Cl-、NO3- | B. | K+、Na+、Cl-、SO42- | ||
| C. | Ca2+、Mg2+、NO3-、HCO3- | D. | Na+、Cl-、CO32-、SO32- |
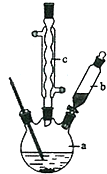
5. 某化学小组采用类似制乙酸乙酯的装置(如图),以环己醇制备环己烯
某化学小组采用类似制乙酸乙酯的装置(如图),以环己醇制备环己烯
已知: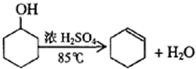
(1)制备粗品
将12.5mL环己醇加入试管A中,再加入l mL浓硫酸,摇匀后放入碎瓷片,缓慢加热至反应完全,在试管C内得到环己烯粗品.A中碎瓷片的作用是防止暴沸,导管B除了导气外还具有的作用是冷凝.
(2)制备精品
①环己烯粗品中含有环己醇和少量酸性杂质等.加入饱和食盐水,振荡、静置、分层,环己烯在上层(填上或下),分液后用b (填入编号)洗涤.
a.KMnO4溶液 b.Na2CO3溶液 c.稀H2SO4
②收集产品时,控制的温度应在83℃左右.
(3)以下区分环己烯精品和粗品的方法,合理的是bc.
a.用酸性高锰酸钾溶液 b.用金属钠 c.测定沸点.
 某化学小组采用类似制乙酸乙酯的装置(如图),以环己醇制备环己烯
某化学小组采用类似制乙酸乙酯的装置(如图),以环己醇制备环己烯已知:

| 密度(g/cm3) | 熔点(℃) | 沸点(℃) | 溶解性 | |
| 环己醇 | 0.96 | 25 | 161 | 能溶于水 |
| 环己烯 | 0.81 | -103 | 83 | 难溶于水 |
将12.5mL环己醇加入试管A中,再加入l mL浓硫酸,摇匀后放入碎瓷片,缓慢加热至反应完全,在试管C内得到环己烯粗品.A中碎瓷片的作用是防止暴沸,导管B除了导气外还具有的作用是冷凝.
(2)制备精品
①环己烯粗品中含有环己醇和少量酸性杂质等.加入饱和食盐水,振荡、静置、分层,环己烯在上层(填上或下),分液后用b (填入编号)洗涤.
a.KMnO4溶液 b.Na2CO3溶液 c.稀H2SO4
②收集产品时,控制的温度应在83℃左右.
(3)以下区分环己烯精品和粗品的方法,合理的是bc.
a.用酸性高锰酸钾溶液 b.用金属钠 c.测定沸点.
2.对于反应X(g)+Y(g)?3Z(g)(正反应为吸热反应),下列可作为平衡状态的标志的是( )
①单位时间内,A、B生成C的分子数与分解C的分子数相等
②体系的温度不再变化
③外界条件不变时,A、B的浓度不随时间而变化
④体系的压强不再变化
⑤体系的分子总数不再变化.
①单位时间内,A、B生成C的分子数与分解C的分子数相等
②体系的温度不再变化
③外界条件不变时,A、B的浓度不随时间而变化
④体系的压强不再变化
⑤体系的分子总数不再变化.
| A. | ①③⑤ | B. | ②③④ | C. | ①③④⑤ | D. | ①②③④⑤ |
19.下列各组无色溶液的离子组在pH=l时能大量共存的是( )
| A. | NH4+、C1-、Mg2+、SO42- | B. | A13+、Cu2+、SO42-、C1- | ||
| C. | Ba2+、K+、NO3-、OH- | D. | Ca2+、Na+、C1-、A1O2- |
20.一定温度下,将a mol PCl5通入一个容积不变的密闭容器中,发生反应:PCl5(g)?PCl3(g)+Cl2(g),平衡时测得混合气体的压强为p1,此时向容器中再通入a mol PCl5,在相同温度下再次达到平衡时,测得压强为p2,下列判断正确的是( )
| A. | 2p1>p2 | B. | PCl5的分解率增大 | ||
| C. | p1>p2 | D. | Cl2的体积分数增大 |

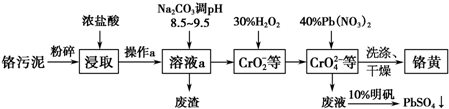
 苯乙酸铜是合成优良催化剂、传感材料--纳米氧化铜的重要前驱体之一.下面是它的一种实验室合成路线:
苯乙酸铜是合成优良催化剂、传感材料--纳米氧化铜的重要前驱体之一.下面是它的一种实验室合成路线: