题目内容
4.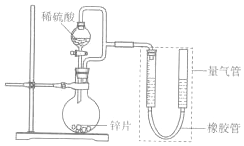 某同学设计计如图所示装罝(部分夹持装置己略去)进行实验探究:
某同学设计计如图所示装罝(部分夹持装置己略去)进行实验探究:(1)用上述装置探究影响化学反应速率的因素.以生成9.0mL气体为计时终点,结果为t1>t2.
| 序号 | V(H2SO4)/mL | C(H2SO4)/mol•L-1 | t/s |
| I | 40 | 1 | t1 |
| II | 40 | 4 | t2 |
②若将锌片换成含杂质的粗锌片,其他条件使其与上述一致,所测得的反应速率均大于上述实验对应的数据.粗锌片中所含杂质可能是BCD (填序号).
A.二氧化硅 B.银 C.铜 D.石墨
(2)用上述装置验证生铁在潮湿空气中会发生吸氧腐蚀
①圆底烧瓶中的试剂可选用BD(填序号)
A.稀HCl B.NaCl溶液 C.乙醇 D.NaOH溶液
②能证明生铁在潮湿空气中会发生吸氧腐蚀的现象是量气管右端液面下降,左端液面上升.
分析 (1)①t1>t2,说明实验Ⅱ反应速率较大,结合浓度的影响判断;
②所含杂质能与锌形成原电池反应;
(2)①生铁在酸性较强的条件下发生析氢腐蚀,发生吸氧腐蚀应在碱性或中性溶液中进行;
②发生吸氧腐蚀时,消耗氧气,烧瓶内压强减小.
解答 解:(1)①t1>t2,说明实验Ⅱ反应速率较大,二者浓度不同,说明在其它条件一定时,化学反应速率随反应物浓度的增大而增大,
故答案为:在其它条件一定时,化学反应速率随反应物浓度的增大而增大;
②由反应速率大于上述实验对应的数据可知所含杂质必能与锌形成原电池,使反应速率增大,锌作负极,比锌不活泼的金属或非金属作正极,则杂质可以是银、铜、石墨,
故答案为:BCD;
(2)①钢铁在中性或碱性环境中易发生吸氧腐蚀,乙醇是非电解质不导电,
故答案为:BD;
②吸氧腐蚀消耗氧气,烧瓶内压强减小,故量气管右端液面下降,左端液面上升,
故答案为:量气管右端液面下降,左端液面上升.
点评 本题考查化学反应速率以及金属的电化学腐蚀的实验探究,把握发生的反应及影响反应速率因素、实验技能为解答的关键,侧重分析与实验能力的考查,题目难度不大.

练习册系列答案
 考前必练系列答案
考前必练系列答案
相关题目
4.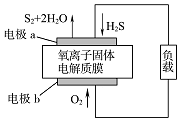 新华网报道:我国固体氧化物燃料电池技术研发取得新突破.科学家利用该技术实现了H2S废气资源回收能量,并得到单质硫的原理如图所示.下列说法正确的是( )
新华网报道:我国固体氧化物燃料电池技术研发取得新突破.科学家利用该技术实现了H2S废气资源回收能量,并得到单质硫的原理如图所示.下列说法正确的是( )
 新华网报道:我国固体氧化物燃料电池技术研发取得新突破.科学家利用该技术实现了H2S废气资源回收能量,并得到单质硫的原理如图所示.下列说法正确的是( )
新华网报道:我国固体氧化物燃料电池技术研发取得新突破.科学家利用该技术实现了H2S废气资源回收能量,并得到单质硫的原理如图所示.下列说法正确的是( )| A. | 电极b为电池的负极 | |
| B. | 电路中每流过4 mol电子,正极消耗44.8 L H2S | |
| C. | 电极b上的电极反应为:O2+4e-+4H+═2H2O | |
| D. | 电极a上的电极反应为:2H2S+2O2--4e-═S2+2H2O |
15.某温度时,VIA元素单质与H2反应生成气态H2X的热化学方程式如下:
$\frac{1}{2}$O2(g)+H2(g)═H2O(g)△H=-242kJ•mol-1
S(g)+H2(g)═H2S(g)△H=-20kJ•mol-1
Se(g)+H2(g)?H2Se(g)△H=+81kJ•mol-1
下列说法正确的是( )
$\frac{1}{2}$O2(g)+H2(g)═H2O(g)△H=-242kJ•mol-1
S(g)+H2(g)═H2S(g)△H=-20kJ•mol-1
Se(g)+H2(g)?H2Se(g)△H=+81kJ•mol-1
下列说法正确的是( )
| A. | 稳定性:H2O<H2S<H2Se | |
| B. | 降温有利于Se与H2反应生成H2Se | |
| C. | O2(g)+2H2S(g)═2H2O(g)+2S(g)△H=-444 kJ•mol-1 | |
| D. | 随着核电荷数的增加,VIA族元素单质与H2的化合反应越容易发生 |
12.用NA表示阿伏加德罗常数的值.下列叙述正确的是( )
| A. | 标准状况下,80gSO3的体积为22.4L | |
| B. | 标准状况下,2.24L Cl2与过量稀NaOH溶液反应,转移的电子总数为0.2NA | |
| C. | 已知反应:2NH3+NO+NO2═2N2+3H2O,每生成28g N2转移的电子数目为3NA | |
| D. | 6.0gSiO2中含有0.1NA个 SiO2分子 |
19.金属钛对体液无毒且有惰性,能与肌肉和骨骼生长在一起,因而有“生物金属”之称.下列有关${\;}_{22}^{48}$Ti和${\;}_{22}^{50}$Ti的说法中正确的是( )
| A. | ${\;}_{22}^{48}$Ti和${\;}_{22}^{50}$Ti中均含有22个中子 | |
| B. | ${\;}_{22}^{48}$Ti和${\;}_{22}^{50}$Ti的化学性质不同 | |
| C. | ${\;}_{22}^{48}$Ti和${\;}_{22}^{50}$Ti互称为同位素 | |
| D. | ${\;}_{22}^{48}$Ti和${\;}_{22}^{50}$Ti为同一核素 |
9.用NA表示阿伏加德罗常数的值.下列叙述中不正确的是( )
| A. | 标准状况下,22.4LHF中的原子数目为2NA | |
| B. | 在18 g18O2中含有NA个氧原子 | |
| C. | 常温常压下,17g的NH3含有的电子数为10NA | |
| D. | NA 个CO2分子中含有4mol极性键 |
16.设NA表示阿伏伽德罗常数的数值,下列说法正确的是( )
| A. | 1mol H3O+中含有的电子数目为11NA | |
| B. | 5.8g熟石膏(2CaSO4•H2O)含有的结晶水分子数目为0.04NA | |
| C. | 28g聚乙烯含有的碳原子数目为2NA | |
| D. | 含NA个Na+的Na2O溶解于1L水中,Na+的物质的量浓度为1 mol•L-1 |
13.1H、2H、3H是三种核素,下列说法不正确的是( )
| A. | 2H原子核内有1个中子 | B. | 它们互称为同位素 | ||
| C. | 它们是同一种原子 | D. | 它们在周期表中占一个格 |
14.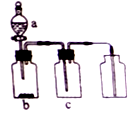 用如图装置制备、净化、收集下表中的四种气体(a、b、c表示相应仪器中加入的试剂),其中可行的是( )
用如图装置制备、净化、收集下表中的四种气体(a、b、c表示相应仪器中加入的试剂),其中可行的是( )
 用如图装置制备、净化、收集下表中的四种气体(a、b、c表示相应仪器中加入的试剂),其中可行的是( )
用如图装置制备、净化、收集下表中的四种气体(a、b、c表示相应仪器中加入的试剂),其中可行的是( )| 选项 | 气体 | a | b | c |
| A | NO2 | 浓硝酸 | 铜片 | NaOH溶液 |
| B | H2 | 稀硫酸 | 锌片 | 浓硫酸 |
| C | NH3 | 浓氨水 | 生石灰 | 碱石灰 |
| D | O2 | 双氧水 | MnO2粉末 | 浓硫酸 |
| A. | A | B. | B | C. | C | D. | D |