题目内容
下列比较中,正确的是( )
| A、同温度同物质的量浓度时,HF比HCN电离平衡常数大,则NaF溶液的pH比NaCN溶液大 |
| B、0.2 mol?L-1 NH4Cl和0.1 mol?L-1 NaOH溶液等体积混合后:c(NH4+)>c(Cl-)>c(Na+)>c(OH-)>c(H+) |
| C、物质的量浓度相等的H2S和NaHS混合溶液中:c(Na+)+c(H+)=2c(S2-)+c(HS-)+c(OH-) |
| D、同浓度的下列溶液中,①NH4Al(SO4)2 ②NH4Cl ③CH3COONH4 ④NH3?H2O;c(NH4+) 由大到小的顺序是:③>②>①>④ |
考点:离子浓度大小的比较
专题:
分析:A.盐对应的酸电离平衡常数越大,对应的酸根离子水解程度越小;
B.0.2mol?L-1NH4Cl和0.1mol?L-1NaOH溶液等体积混合生成NH3?H2O,NH3?H2O为弱电解质;
C.从溶液的电中性原则分析;
D.从影响盐类水解的角度分析,NH3?H2O为弱电解质,电离程度较小.
B.0.2mol?L-1NH4Cl和0.1mol?L-1NaOH溶液等体积混合生成NH3?H2O,NH3?H2O为弱电解质;
C.从溶液的电中性原则分析;
D.从影响盐类水解的角度分析,NH3?H2O为弱电解质,电离程度较小.
解答:
解:A.因为HF比HCN电离平衡常数大,HF比HCN易电离,NaF比NaCN水解程度小,NaF溶液的pH比NaCN溶液的pH小,故A错误;
B.等体积混合生成NH3?H2O,NH3?H2O为弱电解质,应有c(Cl-)>c(NH4+),故B错误;
C.溶液存在电荷守恒,即c(Na+)+c(H+)=2c(S2-)+c(HS-)+c(OH-),故C正确;
D.①NH4Al(SO4)2中NH4+和Al3+水解都呈酸性,相互抑制,则NH4+水解程度较小,③CH3COONH4中NH4+与CH3COO-水解相互促进,NH4+水解程度较大,则c(NH4+)由大到小的顺序是:①>②>③,NH3?H2O为弱电解质,电离程度较小,c(NH4+)浓度最小,故有c(NH4+)由大到小的顺序是:①>②>③>④,故D错误;
故选C.
B.等体积混合生成NH3?H2O,NH3?H2O为弱电解质,应有c(Cl-)>c(NH4+),故B错误;
C.溶液存在电荷守恒,即c(Na+)+c(H+)=2c(S2-)+c(HS-)+c(OH-),故C正确;
D.①NH4Al(SO4)2中NH4+和Al3+水解都呈酸性,相互抑制,则NH4+水解程度较小,③CH3COONH4中NH4+与CH3COO-水解相互促进,NH4+水解程度较大,则c(NH4+)由大到小的顺序是:①>②>③,NH3?H2O为弱电解质,电离程度较小,c(NH4+)浓度最小,故有c(NH4+)由大到小的顺序是:①>②>③>④,故D错误;
故选C.
点评:本题考查离子浓度大小比较,题目难度中等,本题易错点为D,注意影响离子水解的因素.

练习册系列答案
相关题目
2月1日上午,一辆满载烟花爆竹的货车在行至连霍高速公路(河南三门峡段)的义昌大桥时突然发生爆炸,导致大桥南半幅被炸毁.爆竹的主要成分为硫磺、炭粉和硝酸钾,为了一些特殊效果还加入镁粉、铁粉、铝粉、锑粉及无机盐.下列说法中不正确的是( )
| A、烟花爆竹爆炸不易使用水来灭火,可用干沙 | ||||
| B、烟花爆竹的燃放产生大量污染气体,应加以限制 | ||||
| C、烟花爆竹燃放过程中硝酸钾做氧化剂 | ||||
D、爆竹爆炸过程中发生反应为2KNO3+3C+S
|
决定1mol气体体积大小的主要因素是( )
| A、分子个数的多少 |
| B、分子间平均距离的大小 |
| C、分子直径的大小 |
| D、相对分子质量的大小 |
下列数量的物质中含对应微粒数目最多的是( )
| A、0.4molNaCl所含离子数 |
| B、标准状况下5.6L CO2所含原子数 |
| C、1L1 mol?L-1盐酸所含HCl分子数 |
| D、10g氖气所含原子数 |
用NA表示阿伏伽德罗常数,下列叙述不正确的是( )
| A、标准情况下,22.4LH2含有的分子数为1NA |
| B、常温常压下,1.06gNa2CO3(相对分子质量为106)含有的Na+离子数为0.02NA |
| C、常温常压下,6.02×1023个CO2分子占有的体积为22.4L |
| D、1L物质的量浓度为0.5mol/L的MgCl2溶液中,含有Cl-个数为1NA |
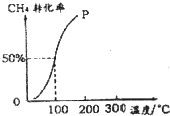 甲醇可作为燃料电池的原料.以CH4和H2O为原料,通过下列反应来制备甲醇.
甲醇可作为燃料电池的原料.以CH4和H2O为原料,通过下列反应来制备甲醇.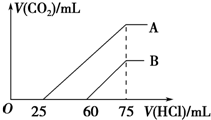 向浓度相等、体积均为50mL的A、B两份NaOH溶液中,分别通入一定量的CO2后,再稀释到100mL.
向浓度相等、体积均为50mL的A、B两份NaOH溶液中,分别通入一定量的CO2后,再稀释到100mL.