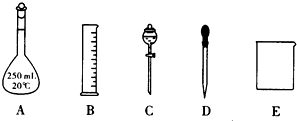
题目内容
现用溶质质量分数为98%、密度为 1.84g?cm-3的 浓H2SO4来配制500mL、0.2mol?L-1的稀H2SO4.可供选择的仪器有:①玻璃棒 ②药匙 ③烧杯 ④胶头滴管 ⑤量筒 ⑥容量瓶 ⑦托盘天平.请回答下列问题:
(1)上述仪器中,在配制稀H2SO4时用不到的有 (填代号).
(2)经计算,需浓H2SO4的体积为 mL,依此确定你选用的量筒规格是 mL.
(3)将浓H2SO4加适量蒸馏水稀释后,冷却至室温,随后全部转移到 mL的容量瓶中,转移时应用玻璃棒 .转移完毕,用少量蒸馏水 烧杯内壁2~3次,并将洗涤液全部转移到容量瓶中,再加适量蒸馏水,振荡容量瓶,使溶液混合均匀.然后缓缓地把蒸馏水直接注入容量瓶直到液面接近刻度1~2cm处时,改用 滴加蒸馏水到瓶颈刻度的地方,使溶液的凹液面正好与刻度线相切.振荡、摇匀后,装瓶、贴签.
(4)在配制过程中,下列操作中,能引起误差偏高的有 (填代号).
①未等稀释后的H2SO4溶液冷却至室温就转移到容量瓶中
②定容时,加蒸馏水超过刻度线,又用胶头滴管吸出
③定容摇匀后,发现液面低于刻度线,又用胶头滴管加蒸馏水至刻度线
④定容时,俯视刻度线.
(1)上述仪器中,在配制稀H2SO4时用不到的有
(2)经计算,需浓H2SO4的体积为
(3)将浓H2SO4加适量蒸馏水稀释后,冷却至室温,随后全部转移到
(4)在配制过程中,下列操作中,能引起误差偏高的有
①未等稀释后的H2SO4溶液冷却至室温就转移到容量瓶中
②定容时,加蒸馏水超过刻度线,又用胶头滴管吸出
③定容摇匀后,发现液面低于刻度线,又用胶头滴管加蒸馏水至刻度线
④定容时,俯视刻度线.
考点:配制一定物质的量浓度的溶液
专题:
分析:(1)根据配制步骤是计算、量取、稀释、移液、洗涤、定容、摇匀、装瓶来分析需要的仪器;
(2)先计算出浓硫酸的物质的量浓度为c=
,然后根据溶液稀释定律C浓V浓=C稀V稀来计算;根据“大而近”的原则,根据需要量取的浓硫酸的体积来选择合适的量筒;
(3)根据容量瓶只有一条刻度线,只能配制与其规格相对应的体积的溶液来选择合适的容量瓶;移液时要用玻璃棒引流;移液完要用水洗涤烧杯和玻璃棒2-3次;定容时要用胶头滴管;
(4)根据c=
并结合溶质的物质的量n和溶液的体积V的变化来进行误差分析.
(2)先计算出浓硫酸的物质的量浓度为c=
| 1000ρω |
| M |
(3)根据容量瓶只有一条刻度线,只能配制与其规格相对应的体积的溶液来选择合适的容量瓶;移液时要用玻璃棒引流;移液完要用水洗涤烧杯和玻璃棒2-3次;定容时要用胶头滴管;
(4)根据c=
| n |
| V |
解答:
解:(1)操作步骤有计算、量取、稀释、洗涤、定容、摇匀等操作,一般先用量筒量取浓硫酸,在烧杯中稀释(可用量筒量取水加入烧杯),并用玻璃棒搅拌.冷却后转移到500mL容量瓶中,并用玻璃棒引流,洗涤烧杯、玻璃棒2-3次,并将洗涤液移入容量瓶中,加水至液面距离刻度线1~2cm时,改用胶头滴管滴加,最后定容颠倒摇匀.所以所需仪器有:量筒、烧杯、玻璃棒、500mL容量瓶、胶头滴管,故用不到的仪器有②⑦,
故答案为:②⑦;
(2)浓硫酸的物质的量浓度为c=
=
=18.4mol/L,设需要的浓硫酸的体积为VmL,根据溶液稀释定律C浓V浓=C稀V稀可知:
18.4mol/L×VmL=0.2mol/L×500mL
解得V=5.4mL;根据“大而近”的原则,量取5.4mL的浓硫酸,应使用10mL的量筒,故答案为:5.4;10;
(3)根据容量瓶只有一条刻度线,只能配制与其规格相对应的体积的溶液来选择合适的容量瓶,故配制500mL的溶液只能选用500ml的容量瓶,故将浓H2SO4加适量蒸馏水稀释后,冷却至室温,随后全部转移到500mL的容量瓶中,转移时应用玻璃棒引流.转移完毕,用少量蒸馏水洗涤烧杯内壁2~3次,并将洗涤液全部转移到容量瓶中,再加适量蒸馏水,振荡容量瓶,使溶液混合均匀.然后缓缓地把蒸馏水直接注入容量瓶直到液面接近刻度1~2cm处时,改用胶头滴管滴加蒸馏水到瓶颈刻度的地方,使溶液的凹液面正好与刻度线相切.振荡、摇匀后,装瓶、贴签,
故答案为:500;引流;洗涤;胶头滴管;
(4)①未等稀释后的H2SO4溶液冷却至室温就转移到容量瓶,则冷却后体积偏小,则浓度偏高,故①选;
②定容时,加蒸馏水超过刻度线,又用胶头滴管吸出,则吸出的不止是水,连溶质也一并吸出,故浓度偏低,故②不选;
③定容摇匀后,发现液面低于刻度线是正常的,又用胶头滴管加蒸馏水至刻度线则导致浓度偏低,故③不选;
④定容时,俯视刻度线,会导致溶液体积偏小,则浓度偏高,故④选;
故选①④.
故答案为:②⑦;
(2)浓硫酸的物质的量浓度为c=
| 1000ρω |
| M |
| 1000×1.84g/ml×98% |
| 98g/mol |
18.4mol/L×VmL=0.2mol/L×500mL
解得V=5.4mL;根据“大而近”的原则,量取5.4mL的浓硫酸,应使用10mL的量筒,故答案为:5.4;10;
(3)根据容量瓶只有一条刻度线,只能配制与其规格相对应的体积的溶液来选择合适的容量瓶,故配制500mL的溶液只能选用500ml的容量瓶,故将浓H2SO4加适量蒸馏水稀释后,冷却至室温,随后全部转移到500mL的容量瓶中,转移时应用玻璃棒引流.转移完毕,用少量蒸馏水洗涤烧杯内壁2~3次,并将洗涤液全部转移到容量瓶中,再加适量蒸馏水,振荡容量瓶,使溶液混合均匀.然后缓缓地把蒸馏水直接注入容量瓶直到液面接近刻度1~2cm处时,改用胶头滴管滴加蒸馏水到瓶颈刻度的地方,使溶液的凹液面正好与刻度线相切.振荡、摇匀后,装瓶、贴签,
故答案为:500;引流;洗涤;胶头滴管;
(4)①未等稀释后的H2SO4溶液冷却至室温就转移到容量瓶,则冷却后体积偏小,则浓度偏高,故①选;
②定容时,加蒸馏水超过刻度线,又用胶头滴管吸出,则吸出的不止是水,连溶质也一并吸出,故浓度偏低,故②不选;
③定容摇匀后,发现液面低于刻度线是正常的,又用胶头滴管加蒸馏水至刻度线则导致浓度偏低,故③不选;
④定容时,俯视刻度线,会导致溶液体积偏小,则浓度偏高,故④选;
故选①④.
点评:本题考查了一定物质的量浓度溶液的配制过程中的计算和误差分析,属于基础型题目,难度不大.

练习册系列答案
相关题目
下列比较中,正确的是( )
| A、同温度同物质的量浓度时,HF比HCN电离平衡常数大,则NaF溶液的pH比NaCN溶液大 |
| B、0.2 mol?L-1 NH4Cl和0.1 mol?L-1 NaOH溶液等体积混合后:c(NH4+)>c(Cl-)>c(Na+)>c(OH-)>c(H+) |
| C、物质的量浓度相等的H2S和NaHS混合溶液中:c(Na+)+c(H+)=2c(S2-)+c(HS-)+c(OH-) |
| D、同浓度的下列溶液中,①NH4Al(SO4)2 ②NH4Cl ③CH3COONH4 ④NH3?H2O;c(NH4+) 由大到小的顺序是:③>②>①>④ |
根据物质的分类,水不属于( )
| A、氧化物 | B、单质 |
| C、化合物 | D、纯净物 |
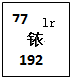 美国有个已经破产了的铱星公司,原来计划发射77颗卫星以实现全球卫星通讯,其公司名称和发射卫星计划数目取材于元素周期表中的铱元素(如图所示).
美国有个已经破产了的铱星公司,原来计划发射77颗卫星以实现全球卫星通讯,其公司名称和发射卫星计划数目取材于元素周期表中的铱元素(如图所示).以下说法正确的是( )
| A、铱原子核外有77个电子 |
| B、铱元素的原子构成了一种非金属化合物 |
| C、铱原子核中有192个中子 |
| D、铱元素的相对原子质量为77 |
下列几种类推结论中,正确的是( )
| A、由2Cu+O2═2CuO可推出同族的硫也有Cu+S═CuS |
| B、Fe3O4可表示为FeO?Fe2O3,则Pb3O4可表示为PbO?Pb2O3 |
| C、Na能与水反应生成H2,K、Ca也能与水反应生成H2 |
| D、CO2与Na2O2反应只生成Na2CO3和O2,故SO2与Na2O2反应只生成Na2SO3和O2 |