题目内容
除去Fe2O3中混有的少量Al2O3,可选用的溶液是( )
| A、盐酸 | B、稀硝酸 |
| C、氨水 | D、氢氧化钠溶液 |
考点:物质的分离、提纯的基本方法选择与应用,两性氧化物和两性氢氧化物
专题:化学实验基本操作
分析:氧化铝是两性氧化物,可以与强酸、强碱反应,利用氧化铝与强碱反应而氧化镁不能反应除去MgO中混有少量Al2O3.
解答:
解:Fe2O3和Al2O3都可与酸反应,则不能用盐酸和硝酸除杂,Al2O3为两性氧化物,可与强碱溶液反应,则可用氢氧化钾溶液分离,因不与氨水反应,则不能用氨水分离,
故选:D.
故选:D.
点评:本题以氧化铝的性质为载体考查物质的分离、提纯,为高考常见题型和高频考点,侧重于学生的分析能力和实验能力的考查,注意把握物质的性质的异同,为解答该题的关键,难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
在1100℃,一定容积的密闭容器中发生反应:X(s)+Y(g)═Q(s)+P(g)△H=+a kJ/mol(a>0),该温度下K=0.203,下列有关该反应的说法正确的是( )
| A、若生成1 molP(g),则放出的热量等于a kJ |
| B、若容器内压强不随时间变化,则可以判断该反应已达到化学平衡状态 |
| C、若升高温度,正反应速率加快,逆反应速率减慢,化学平衡正向移动 |
| D、达到化学平衡状态时,若c(Y)=0.100mol/L,则c(P)=0.0203 mol/L |
下列的分离方法不正确的是( )
| A、用过滤的方法除去食盐水中的泥沙 |
| B、用蒸馏的方法将自来水制成蒸馏水 |
| C、用酒精萃取碘水中的碘 |
| D、用加热的方法除去苏打中的小苏打 |
对实验Ⅰ~Ⅳ的叙述正确的是( )
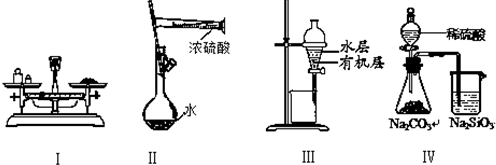

| A、实验Ⅰ:用托盘天平称量一定质量的氯化钠固体 |
| B、实验Ⅱ:配制一定物质的量浓度的硫酸 |
| C、实验Ⅲ:用苯萃取溴水中的溴后进行分液 |
| D、实验Ⅳ:比较硫酸、碳酸和硅酸酸性强弱 |
下列说法正确的是( )
| A、钢铁在海水中比在河水中更易被腐蚀,主要原因是海水含氧量高于河水 |
| B、蚕丝、羊毛和淀粉分别属于纤维素、蛋白质和多糖 |
| C、不可用铝制餐具长时间存放酸性、碱性食物 |
| D、凡含有食品添加剂的食物对人体健康均有害,不宜食用 |
对于反应H2(g)+Cl2(g)═2HCl(g)(该反应为放热反应)的能量变化描述正确的是( )
| A、反应物总能量小于成物总能量 |
| B、断键和成键过程中都释放能量 |
| C、断键过程中吸收能量,成键过程中释放能量 |
| D、断键过程中释放能量,成键过程中吸收能量 |
