题目内容
6. 氮、碳都是重要的非金属元素,含氮、碳元素的物质在工业生产中有重要的应用.
氮、碳都是重要的非金属元素,含氮、碳元素的物质在工业生产中有重要的应用.(1)一定条件下,铁可以和CO2发生反应:Fe(s)+CO2(g)?FeO(s)+CO(g),已知该反应的平衡常数K与温度T的关系如图所示.
①该反应的逆反应是放热(填“吸热”或“放热”)反应.
②T℃、p pa压强下,在体积为VL的容器中进行反应,下列能说明反应达到平衡状态的是A.
A、混合气体的平均相对分子质量不再变化;
B、容器内压强不再变化;
C、v正(CO2)=v逆(FeO)
③T1温度下,向体积为V L的密闭容器中加入足量铁粉并充入一定量的CO2,反应过程中CO和CO2物质的量与时间的关系如图乙所示.则CO2的平衡转化率为$\frac{2}{3}$(用分数表示),平衡时混合气体的密度与起始时气体的密度之比为$\frac{25}{33}$(分数表示).
(2)在恒温条件下,起始时容积均为5L的甲、乙两密闭容器中(甲为恒容容器、乙为恒压容器),均进行反应:N2+3H2?2NH3,有关数据及平衡状态特定如表.
| 容器 | 起始投入 | 达平衡时 | |||
| 甲 | 2mol N2 | 3mol H2 | 0mol NH3 | 1.5mol NH3 | 同种物质的体积分数相同 |
| 乙 | a mol N2 | b mol H2 | 0mol NH3 | 1.2mol NH3 | |
(3)一定条件下,2.24L(折算为标准状况)N2O和CO的混合气体在点燃条件恰好完全反应,放出b kJ热量.生成的3种产物均为大气组成气体,并测得反应后气体的密度是反应前气体密度的 $\frac{6}{7}$倍.请写出该反应的热化学方程式4N2O(g)+2CO(g)═4N2(g)+2CO2(g)+O2(g)△H=-60bkJ•mol-1.
分析 (1)①图象甲中平衡常数曲线随温度升高增大,说明正反应为吸热反应,逆向为放热反应;
②当反应达到平衡状态时,正、逆反应速率相等(同种物质),各物质的浓度、含量不再改变,以及由此衍生的一些物理量也不变,以此进行判断;
③T1温度下反应的平衡常数为2,结合平衡三段式列式计算,转化率=$\frac{消耗量}{起始量}$×100%,平衡时混合气体的密度与起始时气体的密度之比为气体摩尔质量之比;
(2)依据图表数据和平衡三段式列式计算,气体压强之比等于气体物质的量之比;
(3)N2O和CO的混合气体在点燃条件恰好完全反应,放出bkJ热量.生成的3种产物均为大气组成气体,为氮气、氧气和二氧化碳,反应后气体的密度是反应前气体密度的 $\frac{6}{7}$倍.相同条件下密度之比等于气体物质的量之比,由于产生三种可参与大气循环的气体,产生的气体为二氧化碳、氮气和氧气,N2O和CO可能发生的反应只能为:N2O+CO=N2+CO2、2N2O=2N2+O2,反应后气体密度减小为反应前的$\frac{6}{7}$,结合质量守恒可知,反应后气体体积增大为反应前的$\frac{7}{6}$,即增大了$\frac{1}{6}$体积,上述两个反应第一个反应前后体积不变,而第二个反应2体积的N2O反应后增大为3体积的N2和O2混合气体,因此可知在原混合气体中有$\frac{1}{3}$体积的N2O直接发生了分解,而剩余$\frac{2}{3}$体积气体中有$\frac{1}{3}$体积的N2O和$\frac{1}{3}$体积的CO发生了第一个反应,据此据此N2O与CO所组成的混合物中气体的体积之比;结合热化学方程式书写方法标注物质聚集状态和对应反应的焓变写出.
解答 解:(1)①图象甲中平衡常数曲线随温度升高而增大,说明正反应为吸热反应,逆向为放热反应,
故答案为:放热;
②Fe(s)+CO2(g)?FeO(s)+CO(g),反应前后是气体体积不变的放热反应,
A、反应前后气体物质的量不变,气体质量发生变化,混合气体的平均相对分子质量不再变化,说明反应达到平衡状态,A正确;
B、反应前后气体体积不变,容器内压强始终不发生变化,不能说明反应达到平衡状态,故B错误;
C、氧化亚铁是固体,不能表示反应速率,故C错误;
故答案为:A;
③T1温度下,向体积为V L的密闭容器中加入足量铁粉并充入一定量的CO2,平衡常数为2,设二氧化碳起始量为x,变化量为y,
Fe(s)+CO2(g)?FeO(s)+CO(g),
起始量 x 0
变化量 y y
平衡量 x-y y
平衡常数K=$\frac{y}{x-y}$=2,所以$\frac{y}{x}$=$\frac{2}{3}$,
二氧化碳转化率$\frac{y}{x}$=$\frac{2}{3}$,
平衡时混合气体的密度与起始时气体的密度之比为气体摩尔质量之比=$\frac{44(x-y)+28y}{x}$:44=$\frac{25}{33}$,
故答案为:$\frac{2}{3}$; $\frac{25}{33}$;
(2)甲、乙两组实验中同种物质的体积分数相同,说明达到相同的平衡状态,乙容器体积V,$\frac{1.5mol}{5L}$=$\frac{1.2mol}{V}$,V=4L
甲组 N2+3H2?2NH3,
起始量 2 3 0
变化量 0.75 2.25 1.5
平衡量 1.25 0.75 1.5
乙组 N2+3H2?2NH3,
起始量 a b 0
变化量 0.6 1.8 1.2
平衡量 a-0.6 b-1.8 1.2
$\frac{1.25mol}{5L}=\frac{(a-0.6)mol}{4L}$,a=1.6mol
$\frac{0.75mol}{5L}$=$\frac{(b-1.8)mol}{4L}$,b=2.4mol
起始时乙容器中的压强是甲容器的倍数 $\frac{1.6mol+2.4mol}{2mol+3mol}$=0.8
故答案为:0.8;
(4)由于产生三种可参与大气循环的气体,则N2O和CO可能发生的反应只能为:N2O+CO=N2+CO2、2N2O=2N2+O2,反应后气体密度减小为反应前的 $\frac{6}{7}$,结合质量守恒可知,反应后气体体积增大为反应前的 $\frac{7}{6}$,即增大了 $\frac{1}{6}$体积,上述两个反应第一个反应前后体积不变,而第二个反应2体积的N2O反应后增大为3体积的N2和O2混合气体,因此可知在原混合气体中有$\frac{1}{3}$体积的N2O直接发生了分解,而剩余$\frac{2}{3}$体积气体中有$\frac{1}{3}$体积的N2O和$\frac{1}{3}$体积的CO发生了第一个反应,即混合气体中有 $\frac{1}{15}$mol的N2O和$\frac{1}{30}$ mol的CO,体积比为2:1,则配平得到反应的化学方程式为;4N2O(g)+2CO(g)═4N2(g)+2CO2(g)+O2(g),2.24L(折算为标准状况)N2O和CO的混合气体物质的量为0.1mol,在点燃条件恰好完全反应,放出bkJ热量,则6mol混合气体完全燃烧放热60bKJ,则热化学方程式为:4N2O(g)+2CO(g)═4N2(g)+2CO2(g)+O2(g)△H=-60b kJ•mol-1,
故答案为:4N2O(g)+2CO(g)═4N2(g)+2CO2(g)+O2(g)△H=-60b kJ•mol-1.
点评 本题考查了化学平衡图象分析,影响因素判断,热化学方程式书写,混合物反应的计算,题目难度中等,涉及焓变、反应热、物质的量的计算,试题计算量较大,充分考查学生的分析、理解能力及化学计算能力,明确发生反应的原理为解答关键.

 快乐小博士巩固与提高系列答案
快乐小博士巩固与提高系列答案| A. | 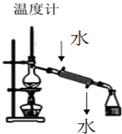 装置用于分离两种沸点相差较大的液体互溶混合物 | |
| B. | 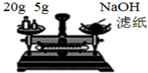 装置称量氢氧化钠固体 | |
| C. | 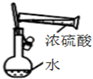 装置配制一定物质的量浓度的稀硫酸 | |
| D. |  装置检查容量瓶是否漏水 |
| A. | 小苏打溶液与乙酸溶液混合 HCO${\;}_{3}^{-}$+CH3COOH═CH3COO-+H2O+CO2↑ | |
| B. | 冷的氢氧化钠溶液中通入氯气:Cl2+2OH-═ClO-+Cl-+H2O | |
| C. | Fe2O3溶于HI溶液中 Fe2O3+6H++2I-═2Fe2++3H2O+I2 | |
| D. | 过量CO2通入NaAlO2溶液中:2AlO${\;}_{2}^{-}$+CO2+3H2O═2Al(OH)3↓+CO2${\;}_{3}^{-}$ |
 在恒温恒容的密闭容器中通入一定量的A、B,发生反应A(g)+2B(g)?3C(g).如图是A的反应速率v(A)随时间变化的示意图.下列说法正确的是( )
在恒温恒容的密闭容器中通入一定量的A、B,发生反应A(g)+2B(g)?3C(g).如图是A的反应速率v(A)随时间变化的示意图.下列说法正确的是( )| A. | 反应物A的浓度:a点小于b点 | |
| B. | 该反应的某种生成物可能对反应起催化作用 | |
| C. | 曲线上的c、d两点都表示达到平衡状态 | |
| D. | A的平均反应速率:ab段大于bc段 |

几种难溶碱开始沉淀和完全沉淀的pH:
| 沉淀物 | Al(OH)3 | Fe(OH)3 | Fe(OH)2 | Ni(OH)2 |
| 开始沉淀 | 3.8 | 2.7 | 7.6 | 7.1 |
| 完全沉淀 | 5.2 | 3.2 | 9.7 | 9.2 |
(1)溶液①中含有金属的离子是AlO2-.
(2)用离子方程式表示加入双氧水的目的2Fe2++H2O2+2H+=2Fe3++2H2O.
(3)操作b调节溶液范围为3.2~7.1,其目的是除去Fe3+,固体②的化学式为Fe(OH)3.
(4)操作a和c需要共同的玻璃仪器是玻璃棒.上述流程中,防止浓缩结晶过程中Ni2+水解的措施是硫酸过量.
(5)如果加入双氧水量不足或“保温时间较短”,对实验结果的影响是产品中混有绿矾.设计实验证明产品中是否含“杂质”:取少量样品溶于蒸馏水,滴加酸性高锰酸钾溶液,若溶液紫色褪去,则产品中含有亚铁离子.(不考虑硫酸镍影响)
(6)取2.000g硫酸镍晶体样品溶于蒸馏水,用0.2000mol•L-1的EDTA(Na2H2Y)标准溶液滴定至终点,消耗EDTA标准溶液为34.50mL.反应为Ni2++H2Y2?=NiY2?+2H.计算样品纯度为97.0%.(已知,NiSO4•7H2O相对分子质量为281,不考虑杂质反应).
| 正 极 | 负 极 | 电解质溶液 | |
| A | Cu | Fe | FeCl3 |
| B | C | Fe | Fe(NO3)3 |
| C | Fe | Zn | Fe2(SO4)3 |
| D | Ag | Fe | CuSO4 |
| A. | A | B. | B | C. | C | D. | D |

 ;在上述由SiCl4制纯硅的反应中,测得每生成1.12kg纯硅需吸收a kJ热量,写出该反应的热化学方程式:SiCl4(g)+2H2(g)$\frac{\underline{\;1100℃\;}}{\;}$Si(s)+4HCl(g)△H=+0.025a kJ•mol-1
;在上述由SiCl4制纯硅的反应中,测得每生成1.12kg纯硅需吸收a kJ热量,写出该反应的热化学方程式:SiCl4(g)+2H2(g)$\frac{\underline{\;1100℃\;}}{\;}$Si(s)+4HCl(g)△H=+0.025a kJ•mol-1