题目内容
16.下列装置及操作均正确的是( )| A. | 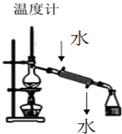 装置用于分离两种沸点相差较大的液体互溶混合物 | |
| B. | 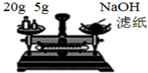 装置称量氢氧化钠固体 | |
| C. | 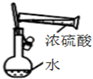 装置配制一定物质的量浓度的稀硫酸 | |
| D. |  装置检查容量瓶是否漏水 |
分析 A.冷凝水应下进上出;
B.NaOH应放在小烧杯中称量;
C.浓硫酸溶于水放热;
D.在容量瓶中注入适量水,塞上瓶塞,食指顶住瓶塞,另一只手托住瓶底,倒立过来,观察是否漏水.
解答 解:A.蒸馏时需在蒸馏烧瓶中加热,用冷凝管冷却,冷凝管冷凝水的流向是下进上出,故A错误;
B.NaOH具有腐蚀性和吸水性,能与空气中二氧化碳反应,称量时应尽量减小与空气的接触面积,应放在小烧杯中称量,故B错误;
C.浓硫酸溶于水放热,应在小烧杯中稀释并冷却,故C错误;
D.在容量瓶中注入适量水,塞上瓶塞,食指顶住瓶塞,另一只手托住瓶底,倒立过来,观察是否漏水,若不漏水,将瓶正立并将瓶塞旋转180°后,再次检验,故D正确.
故选D.
点评 本题考查较为综合,涉及基础实验操作,侧重于学生的分析能力和实验能力的考查,为高考常见题型,注意相关知识的学习与积累,难度不大.

练习册系列答案
相关题目
6.今有一混合物的水溶液,只可能含有以下离子中的若干种:K+、NH${\;}_{4}^{+}$、Cl-、Mg2+、Ba2+、CO${\;}_{3}^{2-}$、SO${\;}_{4}^{2-}$,现取三份溶液各100mL进行如下实验:
(1)第一份加入AgNO2溶液有沉淀产生.
(2)第二份加足量NaOH溶液加热后,收集到气体0.04mol.
(3)第三份加足量BaCl2溶液后,得干燥沉淀6.63g,经足量盐酸洗涤、干燥后,沉淀质量为4.66g.(已知NH${\;}_{4}^{+}$与OH-的反应为NH${\;}_{4}^{+}$+OH-$\frac{\underline{\;\;△\;\;}}{\;}$NH3↑+H2O)根据上述实验,以下推测中不正确的是( )
(1)第一份加入AgNO2溶液有沉淀产生.
(2)第二份加足量NaOH溶液加热后,收集到气体0.04mol.
(3)第三份加足量BaCl2溶液后,得干燥沉淀6.63g,经足量盐酸洗涤、干燥后,沉淀质量为4.66g.(已知NH${\;}_{4}^{+}$与OH-的反应为NH${\;}_{4}^{+}$+OH-$\frac{\underline{\;\;△\;\;}}{\;}$NH3↑+H2O)根据上述实验,以下推测中不正确的是( )
| A. | 100mL溶液中一定只有0.02molK+ | B. | 溶液中CO${\;}_{3}^{2-}$浓度为0.1mol/L | ||
| C. | 不能确定Cl-是否存在 | D. | Ba2+和Mg2+一定不存在 |
7.下列物质属于天然高分子的是( )
| A. | 聚氯乙烯 | B. | 蚕丝 | C. | 塑料 | D. | 合成橡胶 |
11.化学学习中常用类推方法,下列类推正确的是( )
| A. | CO2为直线形分子,SO2也为直线形分子 | |
| B. | 固态CS2是分子晶体,固态SiO2也是分子晶体 | |
| C. | NCl3中N原子是sp3杂化,BCl3中B原子也是sp3杂化 | |
| D. | Al(OH)3能溶于NaOH溶液,Be(OH)2也能溶于NaOH溶液 |
1.下列有关说法不正确的是( )
| A. | 纤维素、油脂、蛋白质均为高分子化合物 | |
| B. | 35%~40%的甲醛水溶液称为福尔马林,具有杀菌、防腐性能 | |
| C. | 淀粉、溴乙烷、脂肪在一定条件下都可以发生水解反应 | |
| D. | 脂肪烃的来源有石油、天然气和煤等,通过石油的裂化及裂解可得到气态烯烃 |
5.2SO2(g)+O2(g)?2SO3(g)△H<0 400℃时体积相同的甲、乙、丙三个容器中,甲容器绝热恒容,充入2molSO2和1molO2,乙容器恒温恒容,充入2molSO3,丙容器恒温恒压,充入2molSO3,充分反应达到平衡
( )
( )
| A. | 甲和丙的K相同 | B. | 乙和丙的正反应速率相同 | ||
| C. | 乙中SO3的体积分数小于丙 | D. | 转化率:α甲(SO2)+α乙(SO3)<1 |
6. 氮、碳都是重要的非金属元素,含氮、碳元素的物质在工业生产中有重要的应用.
氮、碳都是重要的非金属元素,含氮、碳元素的物质在工业生产中有重要的应用.
(1)一定条件下,铁可以和CO2发生反应:Fe(s)+CO2(g)?FeO(s)+CO(g),已知该反应的平衡常数K与温度T的关系如图所示.
①该反应的逆反应是放热(填“吸热”或“放热”)反应.
②T℃、p pa压强下,在体积为VL的容器中进行反应,下列能说明反应达到平衡状态的是A.
A、混合气体的平均相对分子质量不再变化;
B、容器内压强不再变化;
C、v正(CO2)=v逆(FeO)
③T1温度下,向体积为V L的密闭容器中加入足量铁粉并充入一定量的CO2,反应过程中CO和CO2物质的量与时间的关系如图乙所示.则CO2的平衡转化率为$\frac{2}{3}$(用分数表示),平衡时混合气体的密度与起始时气体的密度之比为$\frac{25}{33}$(分数表示).
(2)在恒温条件下,起始时容积均为5L的甲、乙两密闭容器中(甲为恒容容器、乙为恒压容器),均进行反应:N2+3H2?2NH3,有关数据及平衡状态特定如表.
起始时乙容器中的压强是甲容器的0.8倍.
(3)一定条件下,2.24L(折算为标准状况)N2O和CO的混合气体在点燃条件恰好完全反应,放出b kJ热量.生成的3种产物均为大气组成气体,并测得反应后气体的密度是反应前气体密度的 $\frac{6}{7}$倍.请写出该反应的热化学方程式4N2O(g)+2CO(g)═4N2(g)+2CO2(g)+O2(g)△H=-60bkJ•mol-1.
 氮、碳都是重要的非金属元素,含氮、碳元素的物质在工业生产中有重要的应用.
氮、碳都是重要的非金属元素,含氮、碳元素的物质在工业生产中有重要的应用.(1)一定条件下,铁可以和CO2发生反应:Fe(s)+CO2(g)?FeO(s)+CO(g),已知该反应的平衡常数K与温度T的关系如图所示.
①该反应的逆反应是放热(填“吸热”或“放热”)反应.
②T℃、p pa压强下,在体积为VL的容器中进行反应,下列能说明反应达到平衡状态的是A.
A、混合气体的平均相对分子质量不再变化;
B、容器内压强不再变化;
C、v正(CO2)=v逆(FeO)
③T1温度下,向体积为V L的密闭容器中加入足量铁粉并充入一定量的CO2,反应过程中CO和CO2物质的量与时间的关系如图乙所示.则CO2的平衡转化率为$\frac{2}{3}$(用分数表示),平衡时混合气体的密度与起始时气体的密度之比为$\frac{25}{33}$(分数表示).
(2)在恒温条件下,起始时容积均为5L的甲、乙两密闭容器中(甲为恒容容器、乙为恒压容器),均进行反应:N2+3H2?2NH3,有关数据及平衡状态特定如表.
| 容器 | 起始投入 | 达平衡时 | |||
| 甲 | 2mol N2 | 3mol H2 | 0mol NH3 | 1.5mol NH3 | 同种物质的体积分数相同 |
| 乙 | a mol N2 | b mol H2 | 0mol NH3 | 1.2mol NH3 | |
(3)一定条件下,2.24L(折算为标准状况)N2O和CO的混合气体在点燃条件恰好完全反应,放出b kJ热量.生成的3种产物均为大气组成气体,并测得反应后气体的密度是反应前气体密度的 $\frac{6}{7}$倍.请写出该反应的热化学方程式4N2O(g)+2CO(g)═4N2(g)+2CO2(g)+O2(g)△H=-60bkJ•mol-1.
 在0.24L由NaCl、MgCl2、CaCl2组成的混合液中,部分离子浓度大小如图所示,回答下列问题.
在0.24L由NaCl、MgCl2、CaCl2组成的混合液中,部分离子浓度大小如图所示,回答下列问题.