题目内容
16.铜及其化合物在工农业生产及日常生活中应用非常广泛.(1)由辉铜矿制取铜的反应过程为:
2Cu2S(s)+3O2 (g)=2Cu2O(s)+2SO2(g)△H=-768.2kJ•mol-1
2Cu2O(s)+Cu2S(s)=6Cu(s)+SO2(g)△H=+116.0kJ•mol-1
热化学方程式:Cu2S(s)+O2(g)=2Cu(s)+SO2(g)△H=-217.4kJ•mol-1.
(2)氢化亚铜是一种红色固体,可由下列反应制备 4CuSO4+3H3PO2+6H2O=4CuH↓+4H2SO4+3H3PO4
①该反应还原剂是H3PO2(写化学式).
②该反应每转移3mol电子,生成CuH的物质的量为1mol.
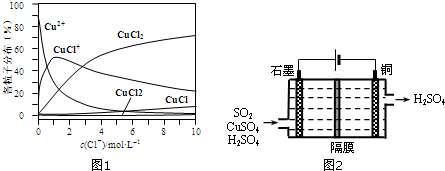
(3)氯化铜溶液中铜各物种的分布分数(平衡时某物种的浓度占各物种浓度之和的分数)与c(Cl-) 的关系如图1所示.
①当c(Cl-)=9mol•L-1时,溶液中主要的3种含铜物种浓度大小关系为c(CuCl2)>c(CuCl+)>c(CuCl3-).
②在c(Cl-)=1mol•L-1的氯化铜溶液中,滴入AgNO3溶液,含铜物种间转化的离子方程式为CuCl++Ag+=AgCl↓+Cu2+(CuCl2+Ag+=CuCl++AgCl↓;CuCl2+2Ag+=Cu2++2AgCl↓)(任写一个).
(4)一种以铜作催化剂脱硫有如下两个过程:①在铜的作用下完成工业尾气中SO2的部分催化氧化,所发生反应为:2SO2+2n Cu+(n+1)O2+(2-2n) H2O=2n CuSO4+(2-2n) H2SO4.从环境保护的角度看,催化脱硫的意义为防止酸雨的发生.
②利用图2所示电化学装置吸收另一部分SO2,并完成Cu的再生.写出装置内所发生反应的离子方程式SO2+2H2O+Cu2+$\frac{\underline{\;通电\;}}{\;}$4H++SO42-+Cu.
分析 (1)利用盖斯定律解答,从待求反应出发,分析待求反应中的反应物和生成物在已知反应中的位置,通过相互加减可得,据盖斯定律(①+②)×$\frac{1}{3}$得到;
(2)①从还原剂的概念出发分析反应物的价态变化即可;
②从价态变化出发分析得失电子总数解答;
(3)①从图上在c(Cl-)=9mol•L-1处,做一条平行与纵轴的虚线,可以比较;
②从图上在c(Cl-)=1mol•L-1处,做一条平行与纵轴的虚线,看哪种微粒最多;
(4)①二氧化硫是一种有毒的气体,排放到空气中可引起酸雨的发生,对环境和人类健康有害,脱硫可以防止酸雨的发生;
②利用电解原理将二氧化硫转化成硫酸吸收,先写出两个电极上上发生的电极反应式,加和就可得到总的离子方程式.
解答 解:(1)①2Cu2S(s)+3O2(g)═2Cu2O(s)+2SO2(g)△H=-768.2kJ•mol-1,
②2Cu2O(s)+Cu2S(s)═6Cu(s)+SO2(g)△H=+116.0kJ•mol-1,
据盖斯定律(①+②)×$\frac{1}{3}$得:Cu2S(s)+O2(g)═2Cu(s)+SO2(g)△H=-217.4KJ/mol,
故答案为:-217.4;
(2)①从反应4CuSO4+3H3PO2+6H2O=4CuH↓+4H2SO4+3H3PO4分析,Cu从+2价变成+1,H从+1价变成-1价,P从+1价变成+5价,还原剂化合价升高,故该反应的还原剂是H3PO2,故答案为:H3PO2;
②Cu从+2价变成+1,4molCu得到4mol电子,H从+1价变成-1价,4mol-1价的H得到8mol电子,共得电子12mol,即每生成4molCuH转移电子12mol,所以每生成1molCuH,转移电子3mol电子,
故答案为:1;
(3)①在c(Cl-)=9mol•L-1处,做一条平行与纵轴的虚线,可见溶液中主要含铜物种浓度大小关系为:c(CuCl2)>c(CuCl+)>c(CuCl3-)>c(Cu2+)>c(CuCl42-),
故答案为:c(CuCl2)>c(CuCl+)>c(CuCl3-);
②从图上可见,在c(Cl-)=1mol•L-1的氯化铜溶液中,主要是Cu2+与Cl-结合生成CuCl+,滴入硝酸银溶液发生反应的方程式为:CuCl++Ag+=AgCl↓+Cu2+(CuCl2+Ag+=CuCl++AgCl↓;CuCl2+2Ag+=Cu2++2AgCl↓)
故答案为:CuCl++Ag+=AgCl↓+Cu2+(CuCl2+Ag+=CuCl++AgCl↓;CuCl2+2Ag+=Cu2++2AgCl↓);
(4)①脱硫可以减少二氧化硫的排放量,防止酸雨的发生;
故答案为:防止酸雨的发生;
②分析图中电解装置,可知左边石墨是电解池的阳极,右边是阴极;阳极放电的物质二氧化硫,失去电子生成硫酸根离子,电极反应式:SO2-2e-+2H2O=SO42-+2H+;阴极放电的物质时铜离子,得到电子被还原成单质铜,电极反应式:Cu2++2e-=Cu;将上述两电极的电极反应式得:SO2+2H2O+Cu2+$\frac{\underline{\;通电\;}}{\;}$4H++SO42-+Cu,
故答案为:SO2+2H2O+Cu2+$\frac{\underline{\;通电\;}}{\;}$4H++SO42-+Cu.
点评 本题考查了反应热的求算,盖斯定律,二氧化硫的污染和治理,电解原理,题目综合性强,难度中等,根据已经掌握的知识可以求解,掌握基础是关键.

 寒假大串联黄山书社系列答案
寒假大串联黄山书社系列答案 氮、碳都是重要的非金属元素,含氮、碳元素的物质在工业生产中有重要的应用.
氮、碳都是重要的非金属元素,含氮、碳元素的物质在工业生产中有重要的应用.(1)一定条件下,铁可以和CO2发生反应:Fe(s)+CO2(g)?FeO(s)+CO(g),已知该反应的平衡常数K与温度T的关系如图所示.
①该反应的逆反应是放热(填“吸热”或“放热”)反应.
②T℃、p pa压强下,在体积为VL的容器中进行反应,下列能说明反应达到平衡状态的是A.
A、混合气体的平均相对分子质量不再变化;
B、容器内压强不再变化;
C、v正(CO2)=v逆(FeO)
③T1温度下,向体积为V L的密闭容器中加入足量铁粉并充入一定量的CO2,反应过程中CO和CO2物质的量与时间的关系如图乙所示.则CO2的平衡转化率为$\frac{2}{3}$(用分数表示),平衡时混合气体的密度与起始时气体的密度之比为$\frac{25}{33}$(分数表示).
(2)在恒温条件下,起始时容积均为5L的甲、乙两密闭容器中(甲为恒容容器、乙为恒压容器),均进行反应:N2+3H2?2NH3,有关数据及平衡状态特定如表.
| 容器 | 起始投入 | 达平衡时 | |||
| 甲 | 2mol N2 | 3mol H2 | 0mol NH3 | 1.5mol NH3 | 同种物质的体积分数相同 |
| 乙 | a mol N2 | b mol H2 | 0mol NH3 | 1.2mol NH3 | |
(3)一定条件下,2.24L(折算为标准状况)N2O和CO的混合气体在点燃条件恰好完全反应,放出b kJ热量.生成的3种产物均为大气组成气体,并测得反应后气体的密度是反应前气体密度的 $\frac{6}{7}$倍.请写出该反应的热化学方程式4N2O(g)+2CO(g)═4N2(g)+2CO2(g)+O2(g)△H=-60bkJ•mol-1.
| A. | 在豆浆中加入盐卤做豆腐 | |
| B. | 在河流入海处易形成沙洲 | |
| C. | 往红褐色的氢氧化铁胶体中加入过量稀盐酸,溶液变黄色 | |
| D. | 肾衰竭等疾病引起的血液中毒,可利用血液透析进行治疗 |


