题目内容
下列有关热化学方程式的表示及说法正确的是( )
| A、已知2H2(g)+O2(g)═2H2O(g)△H=-483.6kJ/mol,则氢气的燃烧热为241.8kJ/mol | ||||
| B、25℃、101 kPa时,1mol S和2mol S的燃烧热不相等 | ||||
C、含20.0g NaOH的稀溶液与稀硫酸完全中和,放出28.7kJ的热量,则表示该反应中和热的热化学方程式为:NaOH(aq)+
| ||||
| D、已知I2(g)+H2(g)═2HI(g)△H1,I2(s)+H2(g)═2HI(g)△H2,则△H1>△H2 |
考点:热化学方程式
专题:化学反应中的能量变化
分析:A、燃烧热是1mol可燃物完全燃烧生成稳定氧化物放出的热量分析;
B、依据燃烧热概念分析判断;
C、依据酸碱中和热的概念分析,中和热是强酸强碱的稀溶液完全反应生成1mol水放出的热量;
D、碘单质固体变化为气体吸热,焓变为负值进行比较大小;
B、依据燃烧热概念分析判断;
C、依据酸碱中和热的概念分析,中和热是强酸强碱的稀溶液完全反应生成1mol水放出的热量;
D、碘单质固体变化为气体吸热,焓变为负值进行比较大小;
解答:
解:A、燃烧热是1mol可燃物完全燃烧生成稳定氧化物放出的热量分析,选项中水是气体不是液态氧化物,故燃烧热大于241.8kJ/mol,故A错误;
B、依据燃烧热概念分析判断,1mol S和2mol S的燃烧热相等,故B错误;
C、依据酸碱中和热的概念分析,中和热是强酸强碱的稀溶液完全反应生成1mol水放出的热量,含20.0g NaOH物质的量为0.5mol的稀溶液与稀硫酸完全中和,放出28.7kJ的热量,则表示该反应中和热的热化学方程式为:NaOH(aq)+
H2SO4(aq)═
Na2SO4(aq)+H2O(l)△H=-57.4kJ/mol,故C正确;
D、碘单质固体变化为气体吸热,焓变为负值进行比较大小,则△H1<△H2,故D错误;
故选C.
B、依据燃烧热概念分析判断,1mol S和2mol S的燃烧热相等,故B错误;
C、依据酸碱中和热的概念分析,中和热是强酸强碱的稀溶液完全反应生成1mol水放出的热量,含20.0g NaOH物质的量为0.5mol的稀溶液与稀硫酸完全中和,放出28.7kJ的热量,则表示该反应中和热的热化学方程式为:NaOH(aq)+
| 1 |
| 2 |
| 1 |
| 2 |
D、碘单质固体变化为气体吸热,焓变为负值进行比较大小,则△H1<△H2,故D错误;
故选C.
点评:本题考查了热化学方程式书写,燃烧热、中和热概念的理解应用,反应热大小比较,注意焓变为负值,题目难度中等.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
将pH=12的氨水与pH=2的盐酸等体积混合后,则正确的是( )
| A、c(NH4+)>c(Cl-)>c(H+)>c(OH-) |
| B、c(NH4+)>c(Cl-)>c(OH-)>c(H+) |
| C、c(Cl-)>c(NH4+)>c(H+)>c(OH-) |
| D、c(Cl-)>c(NH4+)>c(OH-)>c(H+) |
下列反应中,盐酸作为氧化剂的是( )
| A、Zn+2HCl═ZnCl2+H2↑ | ||||
| B、FeS+2HCl═FeCl2+H2S↑ | ||||
| C、NH3+HCl═NH4Cl | ||||
D、MnO2+4HCl
|
下列离子方程式正确的是( )
| A、碳酸钙加入稀盐酸中:CO32-+H+═H2O+CO2↑ |
| B、硫酸铜溶液与氢氧化钡溶液混合:Ba2++20H-+SO42-+Cu2+═BaSO4↓+Cu(OH)2+ |
| C、硝酸银溶液中加入铜粉:Ag++Cu═Ag+Cu2+ |
| D、铁粉加入稀盐酸中:2Fe+6H+═3H2↑+2Fe3+ |
下列说法不正确的是( )
| A、化学反应的速率越大,化学反应的限度越大 |
| B、化学反应中既有物质变化,又有能量变化 |
| C、化学反应的实质是旧键的断裂,新键的形成 |
| D、可逆反应达到化学平衡状态,反应依然在进行 |
下列说法正确的是( )
| A、氢氧化钠溶液应保存在带磨砂玻璃塞的无色细口瓶中 |
| B、硅是制造光导纤维的材料 |
| C、水玻璃可用作木材防火剂 |
| D、水晶是一种无色,坚硬难熔的硅酸盐 |
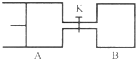 如图所示,向A和B中都充入2mol X和2mol Y,起始时VA=0.8aL,VB=aL,在相同温度和有催化剂的条件下,两容器中各自发生下列反应X(g)+Y(g)?2Z(g)+W(g)△H<0,达到平衡时,VA=0.9aL,则下列说法错误的是( )
如图所示,向A和B中都充入2mol X和2mol Y,起始时VA=0.8aL,VB=aL,在相同温度和有催化剂的条件下,两容器中各自发生下列反应X(g)+Y(g)?2Z(g)+W(g)△H<0,达到平衡时,VA=0.9aL,则下列说法错误的是( )| A、两容器中达到平衡的时间A<B |
| B、A容器中X的转化率为25%,且比B容器中X的转化率小 |
| C、打开K一段时间达到平衡时,A的体积为0.8aL(连通管中气体体积不计) |
| D、打开K达到新平衡后,升高B容器温度,A容器体积一定减小 |
