题目内容
完全吸收11.2LCl2(标准状况),至少需要2.5mol/L的NaOH溶液的体积为多少升?生成NaClO的物质的量是多少?
考点:化学方程式的有关计算
专题:计算题
分析:发生反应:2NaOH+C12=NaCl+NaClO+H2O,根据n=
计算氯气的物质的量,再根据方程式计算消耗NaOH的物质的量、生成次氯酸钠的物质的量,根据V=
计算需要氢氧化钠溶液的体积.
| V |
| Vm |
| n |
| c |
解答:
解:标况下,11.2L氯气的物质的量=
=0.5mol,
2NaOH+Cl2=NaCl+NaClO+H2O
2 1 1
n(NaOH) 0.5mol n(NaClO)
n(NaOH)=
=1mol,故V(NaOH)=
=0.4L;
n(NaClO)=
=0.5mol,
答:至少需要2.5mol/L的NaOH溶液的体积为0.4L,生成NaClO的物质的量是0.5mol.
| 11.2L |
| 22.4L/mol |
2NaOH+Cl2=NaCl+NaClO+H2O
2 1 1
n(NaOH) 0.5mol n(NaClO)
n(NaOH)=
| 0.5mol×2 |
| 1 |
| 1mol |
| 2.5mol/L |
n(NaClO)=
| 0.5mol×1 |
| 1 |
答:至少需要2.5mol/L的NaOH溶液的体积为0.4L,生成NaClO的物质的量是0.5mol.
点评:本题考查化学方程式的有关计算,比较基础,注意掌握化学方程式表示的意义.

练习册系列答案
相关题目
下列关于电解池的叙述中不正确的是( )
| A、与电源正极相连的是电解池的阴极 |
| B、与电源负极相连的是电解池的阴极 |
| C、在电解池的阳极发生氧化反应 |
| D、电子从电源的负极沿导线流入电解池的阴极 |
 某化学课外小组用如图装置制取溴苯.先向分液漏斗中加入苯和液溴,再将混合液慢慢滴入反应器A(A下端活塞关闭)中.
某化学课外小组用如图装置制取溴苯.先向分液漏斗中加入苯和液溴,再将混合液慢慢滴入反应器A(A下端活塞关闭)中.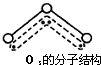 ,呈V型,键角116.5℃.三个原子以一个O原子为中心,与另外两个O原子分别构成一个非极性共价键;中间O原子提供2个电子,旁边两个O原子各提供1个电子,构成一个特殊的化学键--三个O原子均等地享有这4个电子.请回答:
,呈V型,键角116.5℃.三个原子以一个O原子为中心,与另外两个O原子分别构成一个非极性共价键;中间O原子提供2个电子,旁边两个O原子各提供1个电子,构成一个特殊的化学键--三个O原子均等地享有这4个电子.请回答: