题目内容
8.已知:I-、Fe2+、SO2、Cl-和H2O2均有还原性.它们在酸性溶液中还原性强弱顺序为:SO2>I->H2O2>Fe2+>Cl-,判断下列反应不能发生的是( )| A. | 2Fe3++SO2+2H2O→SO42-+2H++2Fe2+ | B. | I2+SO2+2H2O→H2SO4+2HI | ||
| C. | H2O2+2H++SO42-→SO2↑+O2↑+2H2O | D. | 2Fe3++2I-→2Fe2++I2 |
分析 根据氧化还原反应中还原剂的还原性大于还原产物的还原性,利用酸性溶液中还原性强弱的顺序是SO2>I->H2O2>Fe2+>Cl-来判断反应能否发生.
解答 解:A、因该反应中S元素的化合价升高,Fe元素的化合价降低,则SO2为还原剂,还原性强弱为SO2>Fe2+,与已知的还原性强弱一致,能发生,故A不选;
B、因该反应中S元素的化合价升高,I元素的化合价降低,则SO2为还原剂,还原性强弱为SO2>I-,与已知的还原性强弱一致,能发生,故B不选;
C、因该反应中O元素的化合价升高,S元素的化合价降低,则H2O2为还原剂,还原性强弱为H2O2>SO2,与已知的还原性强弱不一致,反应不能发生,故C选;
D、因该反应中Fe元素的化合价降低,I元素的化合价升高,则I-为还原剂,还原性强弱为I->Fe2+,与已知的还原性强弱一致,能发生,故D不选.
故选C.
点评 本题考查利用已知的还原性强弱来判断化学反应的发生,学生应学会利用化合价来分析反应中的还原剂,并利用还原剂的还原性大于还原产物的还原性来解答即可,题目难度不大.

练习册系列答案
 优生乐园系列答案
优生乐园系列答案 新编小学单元自测题系列答案
新编小学单元自测题系列答案
相关题目
18.随着卤素原子核电荷数的递增,下列递变规律正确的是( )
| A. | 单质的熔沸点逐渐升高 | B. | 氢化物的稳定性逐渐增强 | ||
| C. | 单质的氧化性逐渐增强 | D. | 元素的非金属性逐渐增强 |
19.下列情况下,反应速率相同的是( )
| A. | 等体积0.1mol/L HCl和0.01mol/L HCl反应 | |
| B. | 等质量锌粒和镁粉分别与等量1 mol/L HCl反应 | |
| C. | 等体积等浓度HCl和HNO3分别与等量1 mol/L碳酸钠溶液 | |
| D. | 等体积0.2 mol/HCl 和0.1 mol/L H2SO4 与等量等表面积的石灰反应 |
3.NH4HCO3是一种离子化合物,下列关于该物质的叙述错误的是( )
| A. | 所含四种元素的原子半径由小到大的顺序为:H<O<N<C | |
| B. | 同周期的三种元素的得电子能力由大到小的顺序为:O>N>C | |
| C. | 与足量烧碱溶液共热的离子方程式为:NH4++OHˉ$\frac{\underline{\;\;△\;\;}}{\;}$NH3↑+H2O | |
| D. | 除去NaCl固体中混有少量的NH4HCO3固体可以采用加热的方法 |
17.下列说法中正确的是( )
| A. | 相对分子质量相同的物质是同种物质 | |
| B. | 分子组成相差若干个CH2的两种有机物互为同系物 | |
| C. | 分子式相同的不同有机物一定是同分异构体 | |
| D. | 符合通式CnH2n+2的不同烃一定互为同系物 |
18.下列金属中与水不可能发生反应的是( )
| A. | 钾 | B. | 铝 | C. | 镁 | D. | 铜 |
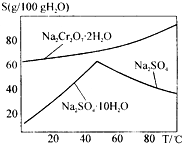 如图是红矾钠Na2Cr2O7•2H2O和Na2SO4的溶解度曲线.现欲对两种物质进行分离,操作I的方法是先对加热后的混合溶液进行②,以得到硫酸钠晶体;然后操作II是①,得到红矾钠晶体.(填编号)
如图是红矾钠Na2Cr2O7•2H2O和Na2SO4的溶解度曲线.现欲对两种物质进行分离,操作I的方法是先对加热后的混合溶液进行②,以得到硫酸钠晶体;然后操作II是①,得到红矾钠晶体.(填编号) 新合成的一种烃,其碳架呈三棱柱体(如图所示)
新合成的一种烃,其碳架呈三棱柱体(如图所示)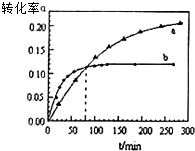 丙酮(CH3COCH3)可作为合成聚异戊二烯橡胶,环氧树脂等物质的重要原料,丙酮在某溶剂里在催化剂作用下发生反应:2CH3COCH3(aq)?CH3COCH2COH(CH3)2(aq).回答下列问题
丙酮(CH3COCH3)可作为合成聚异戊二烯橡胶,环氧树脂等物质的重要原料,丙酮在某溶剂里在催化剂作用下发生反应:2CH3COCH3(aq)?CH3COCH2COH(CH3)2(aq).回答下列问题