题目内容
13.原子序数为12和16的两种元素,它们的最高价氧化物对应的水化物分别是( )| A. | Ca(OH)2、H2SO4 | B. | Mg(OH)2、H2SO4 | C. | KOH、HCl | D. | Al(OH)3、H3PO4 |
分析 原子序数为12和16的两种元素,分别为Mg、S,最高价氧化物对应的水化物分别为碱、酸,以此来解答.
解答 解:原子序数为12和16的两种元素,分别为Mg、S,最高价分别为+2价、+6价,则最高价氧化物对应的水化物分别为Mg(OH)2、H2SO4,
故选B.
点评 本题考查原子结构与元素的性质,为高频考点,把握原子序数判断元素、元素的最高价氧化物的水化物为解答的关键,侧重分析与应用能力的考查,注意规律性知识的应用,题目难度不大.

练习册系列答案
相关题目
18.下列物质的转变,不能一步实现的是( )
| A. | K2CO3→KOH | B. | Fe2O3→Fe (OH)3 | C. | Zn→ZnCl2 | D. | MgCl2→Mg(OH)2 |
19.下列说法正确的是( )
| A. | 不能发生丁达尔效应的分散系有氯化钠溶液、水等 | |
| B. | 将1 L 2 mol/L的FeCl3溶液制成胶体后,其中含有氢氧化铁胶粒数为2NA | |
| C. | 黄河入海口处三角洲的形成与胶体性质有关 | |
| D. | 电泳现象说明胶体带电 |
2.某液态芳香烃的相对分子质量为106,其分子结构中含有一个苯环,具有这种结构的同分异构体共有( )
| A. | 2种 | B. | 5种 | C. | 4种 | D. | 3种 |
3.磷、硫元素的单质和化合物应用广泛.
(1)磷元素的原子结构示意图是 .
.
(2)磷酸钙与焦炭、石英砂混合,在电炉中加热到1 500℃生成白磷,反应为:
2Ca3(PO4)2+6SiO2═6CaSiO3+P4O10
10C+P4O10═P4+10CO
每生成1mol P4时,就有20 mol电子发生转移.
(3)硫代硫酸钠(Na2S2O3)是常用的还原剂.在维生素C(化学式C6H8O6)的水溶液中加入过量I2溶液,使维生素C完全氧化,剩余的I2用Na2S2O3溶液滴定,可测定溶液中维生素C的含量.发生的反应为:
C6H8O6+I2═C6H6O6+2H++2I-
2SO32-+I2═S4O62-+2I-
在一定体积的某维生素C溶液中加入a mol/L I2溶液V1 mL,充分反应后,用Na2S2O3溶液滴定剩余的I2,消耗b mol/L Na2S2O3溶液V2 mL.该溶液中维生素C的物质的量是$\frac{a{V}_{1}-0.5b{V}_{2}}{1000}$ mol.
(4)在酸性溶液中,碘酸钾(KIO3)和亚硫酸钠可发生如下反应:
2IO3-+5SO32-+2H+═I2+5SO42-+H2O
生成的碘可以用淀粉溶液检验,根据反应溶液出现蓝色所需的时间来衡量该反应的速率.
某同学设计实验如下表所示:
该实验的目的是探究温度、亚硫酸钠溶液浓度与该反应速率的关系;
表中V2=40 mL.
(1)磷元素的原子结构示意图是
 .
.(2)磷酸钙与焦炭、石英砂混合,在电炉中加热到1 500℃生成白磷,反应为:
2Ca3(PO4)2+6SiO2═6CaSiO3+P4O10
10C+P4O10═P4+10CO
每生成1mol P4时,就有20 mol电子发生转移.
(3)硫代硫酸钠(Na2S2O3)是常用的还原剂.在维生素C(化学式C6H8O6)的水溶液中加入过量I2溶液,使维生素C完全氧化,剩余的I2用Na2S2O3溶液滴定,可测定溶液中维生素C的含量.发生的反应为:
C6H8O6+I2═C6H6O6+2H++2I-
2SO32-+I2═S4O62-+2I-
在一定体积的某维生素C溶液中加入a mol/L I2溶液V1 mL,充分反应后,用Na2S2O3溶液滴定剩余的I2,消耗b mol/L Na2S2O3溶液V2 mL.该溶液中维生素C的物质的量是$\frac{a{V}_{1}-0.5b{V}_{2}}{1000}$ mol.
(4)在酸性溶液中,碘酸钾(KIO3)和亚硫酸钠可发生如下反应:
2IO3-+5SO32-+2H+═I2+5SO42-+H2O
生成的碘可以用淀粉溶液检验,根据反应溶液出现蓝色所需的时间来衡量该反应的速率.
某同学设计实验如下表所示:
| 0.01mol/LKIO3酸性溶液 (含淀粉)的体积/mL | 0.01mol/L Na2SO3溶液 的体积/mL | H2O 的体积 /mL | 实验温 度/℃ | 溶液出现 蓝色时所 需时间/s | |
| 实验1 | 5 | V1 | 35 | 25 | |
| 实验2 | 5 | 5 | 40 | 25 | |
| 实验3 | 5 | 5 | V2 | 0 |
表中V2=40 mL.
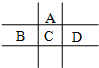 有A、B、C、D、E五种短周期元素,已知A、B、C、D四种元素在周期表中的位置如图所示,其中C元素的最高价氧化物对应的水化物浓溶液是一种常见的干燥剂.D在海水中大量富集.E的氧化物是两性氧化物,回答下列问题:
有A、B、C、D、E五种短周期元素,已知A、B、C、D四种元素在周期表中的位置如图所示,其中C元素的最高价氧化物对应的水化物浓溶液是一种常见的干燥剂.D在海水中大量富集.E的氧化物是两性氧化物,回答下列问题:
 .
.