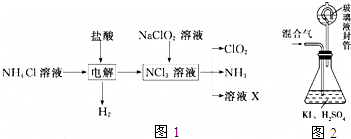
题目内容
13.在如图所示的物质转化关系中(部分反应中的生成物没有全部列出,反应条件未全部列出),常温常压下,单质B为黄绿色气体,单质C为无色气体,E的溶液是无色的,H是红褐色的固体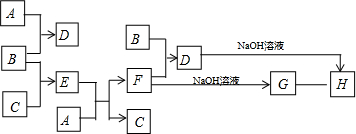
请回答下列问题:
(1)D的化学式为FeCl3.
(2)E的电子式为
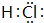 .
.(3)反应G+O2+H2O→H的化学方程式为4Fe(OH)2+O2+2H2O=4Fe(OH)3.
(4)反应B+F→D的离子方程式为Fe+2Fe3+=3Fe2+.
分析 常温常压下,单质B为黄绿色气体,则B为Cl2,B与F反应得到D,D与氢氧化钠溶液反应得到H是红褐色的固体,则H为Fe(OH)3,D中含有铁离子,氯气与A反应得到D,氯气与无色气体单质C反应得到E,E的溶液与A反应得到F与C,则A为Fe、D为FeCl3、C为H2、E为HCl、F为FeCl2、G为Fe(OH)2,据此解答.
解答 解:常温常压下,单质B为黄绿色气体,则B为Cl2,B与F反应得到D,D与氢氧化钠溶液反应得到H是红褐色的固体,则H为Fe(OH)3,D中含有铁离子,氯气与A反应得到D,氯气与无色气体单质C反应得到E,E的溶液与A反应得到F与C,则A为Fe、D为FeCl3、C为H2、E为HCl、F为FeCl2、G为Fe(OH)2.
(1)D的化学式为FeCl3,故答案为:FeCl3;
(2)E为HCl,电子式为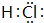 ,故答案为:
,故答案为: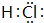 ;
;
(3)反应G+O2+H2O→H的化学方程式为:4Fe(OH)2+O2+2H2O=4Fe(OH)3,
故答案为:4Fe(OH)2+O2+2H2O=4Fe(OH)3;
(4)反应B+F→D的离子方程式为:Fe+2Fe3+=3Fe2+,
故答案为:Fe+2Fe3+=3Fe2+.
点评 本题考查无机物推断,基本属于猜测验证型题目,物质的颜色是推断突破口,再结合转化关系推断,需要学生熟练掌握元素化合物性质,难度中等.

练习册系列答案
 鹰派教辅衔接教材河北教育出版社系列答案
鹰派教辅衔接教材河北教育出版社系列答案
相关题目
3.一定温度下,在恒容容器中,反应2X(g)+Y(g)?3Z(g)达到限度的标志是( )
| A. | 单位时间内生成2n mol X,同时消耗nmol Y | |
| B. | X的生成速率与Z的生成速率相等 | |
| C. | X、Y、Z的浓度相等 | |
| D. | 容器内气体的压强不再变化 |
1.分子式为C7H8O芳香族化合物A,与金属钠无反应,与浓氢碘酸作用生成B和C,B能与NaOH反应,并与FeCl3作用呈紫色,C与硝酸银乙醇溶液作用产生黄色沉淀,推断A、B、C的结构,写出各步反应式.
18.下列说法正确的是( )
| A. | 114号元素在周期表中第七周期第VIA族,属于金属元素 | |
| B. | 晶体硅熔点高硬度大,可用于制作光导纤维 | |
| C. | 为了除去MgCl2酸性溶液中的Fe3+而得到较纯净的MgCl2溶液,可在加热搅拌的条件下加入MgCO3,过滤后,再向滤液中加入适量的盐酸 | |
| D. | 光束通过下列分散系①有尘埃的空气②明矾溶液③墨水④稀豆浆时,都能产生丁达尔效应 |
4.下列化学反应属于吸热反应的是( )
| A. | 木炭燃烧 | B. | 铝热反应 | ||
| C. | 煅烧石灰石 | D. | 氢氧化钠和硝酸反应 |
5.下列叙述正确的是(用NA代表阿伏加德罗常数的值)( )
| A. | 1 mol•L-1NaCl溶液含有NA个Na+ | |
| B. | 1 L 0.1 mol•L-1氨水含有0.1 NA个OH- | |
| C. | 电解饱和食盐水若产生2 g氢气,则转移2 NA个电子 | |
| D. | 将0.1 mol氯化铝溶于1 L水中,所得溶液含有0.1 NA个Al3+ |