题目内容
4.下列说法不正确的是( )| A. | 共价化合物形成的分子之间均存在分子间作用力 | |
| B. | SO2和SiO2的晶体类型不相同 | |
| C. | F2、Cl2、Br2、I2的熔沸点逐渐升高,是因为分子间作用力越来越大 | |
| D. | H2O的热稳定性大于H2S,是因为水分子间存在氢键 |
分析 A.存在于分子之间的作用力属于分子间作用力;
B.SO2属于分子晶体,SiO2属于原子晶体;
C.结构组成相似的分子,相对分子质量越大,分子间作用力越大,熔沸点越高;
D.分子的稳定性与氢键无关.
解答 解:A.存在于分子之间的作用力属于分子间作用力,所以共价化合物形成的分子之间均存在分子间作用力,故A正确;
B.SO2属于分子晶体,SiO2属于原子晶体,二者晶体类型不相同,故B正确;
C.结构组成相似的分子,相对分子质量越大,分子间作用力越大,熔沸点越高,所以F2、Cl2、Br2、I2的熔沸点逐渐升高,故C正确;
D.H2O的热稳定性大于H2S,是因为水分子中H-O的键能大于H2S中H-S的键能,键能越大,分子越稳定,分子的稳定性与氢键无关,故D错误.
故选D.
点评 本题考查了分子间作用力、晶体类型的判断、晶体熔沸点的比较等,题目难度不大,侧重于基础知识的考查,注意把握氢键对物质性质的影响.

练习册系列答案
相关题目
14.下列表示对应化学反应的离子方程式正确的是( )
| A. | 大理石与盐酸反应:CO32-+2H+=H2O+CO2↑ | |
| B. | 向NH4HCO3溶液中加过量的NaOH溶液并加热:NH4++OH-$\frac{\underline{\;\;△\;\;}}{\;}$NH3↑+H2O | |
| C. | 将过量SO2通入冷氨水中:SO2+NH3•H2O=HSO3-+NH4+ | |
| D. | 用稀硝酸洗涤试管内壁的银镜:Ag+2H++NO3-=Ag++NO↑+H2O |
15.一定条件下,可逆反应X(g)+3Y(g)?2Z(g),若X、Y、Z起始浓度分别为c1、c2、c3(均不为0),平衡时X、Y、Z的浓度分别为0.1mol•L-1、0.3mol•L-1、0.08mol•L-1,则下列判断正确的是( )
| A. | c1:c2的值不能确定 | |
| B. | 平衡时,Y和Z的生成速率之比为1:1 | |
| C. | 0.48mol•L-1<c1+c2+c3<0.56mol•L-1 | |
| D. | c1的取值范围为0<c1<0.14 mol•L-1 |
12.将如图所示实验装置的K闭合,下列判断正确的是( )
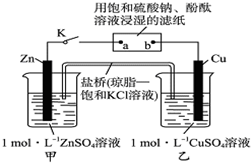

| A. | 电子沿Zn→a→b→Cu路径流动 | B. | Cu电极上发生氧化反应 | ||
| C. | 片刻后可观察到滤纸a点变红色 | D. | 片刻后甲池中c(SO42-)增大 |
19.已知七种短周期元素a~g的有关信息如表所示:
下列推断不正确的是( )
| 元素编号 | a | b | c | d | e | f | g |
| 原子半径/nm | 0.037 | 0.074 | 0.082 | 0.102 | 0.143 | 0.152 | 0.186 |
| 最高化合价或最低化合价 | +1 | -2 | +3 | -2 +6 | +3 | +1 | +1 |
| A. | 氢化物稳定性的强弱:b>d | |
| B. | 元素e的氧化物只能与酸反应 | |
| C. | 金属性的强弱:f<g | |
| D. | 元素a与元素d形成的化合物属于共价化合物 |
13.在反应H2+Cl2=2HCl中,已知H-H键能为436kJ/mol,Cl-Cl键能为247kJ/mol,H-Cl键能为431kJ/mol,判断该反应是( )
| A. | 每生成2molHCl放出179kJ热量 | B. | 每生成1molHCl放出179kJ热量 | ||
| C. | 每生成2molHCl吸收179kJ热量 | D. | 每生成1molHCl吸收179kJ热量 |
14.某同学写出的下列烷烃的名称中,不正确的是( )
| A. | 2,3-二甲基丁烷 | B. | 2,5-二甲基-4-乙基己烷 | ||
| C. | 2-甲基-3-乙基戊烷 | D. | 2,2,3,3-四甲基丁烷 |



