题目内容
19.已知七种短周期元素a~g的有关信息如表所示:| 元素编号 | a | b | c | d | e | f | g |
| 原子半径/nm | 0.037 | 0.074 | 0.082 | 0.102 | 0.143 | 0.152 | 0.186 |
| 最高化合价或最低化合价 | +1 | -2 | +3 | -2 +6 | +3 | +1 | +1 |
| A. | 氢化物稳定性的强弱:b>d | |
| B. | 元素e的氧化物只能与酸反应 | |
| C. | 金属性的强弱:f<g | |
| D. | 元素a与元素d形成的化合物属于共价化合物 |
分析 a、f、g的最高正价为+1,为第ⅠA族元素,原子半径a<f<g,故a为H元素、f为Li元素、g为Na元素;b、d的最低负极为-2价,处于第ⅥA族,b的原子半径较小,故b为O元素,d为S元素;c、e的最高正价为+3,处于第ⅢA族,c的原子半径较小,故c为B元素、e为Al元素,据此结合元素周期律知识进行解答.
解答 解:a、f、g的最高正价为+1,为第ⅠA族元素,原子半径a<f<g,故a为H元素、f为Li元素、g为Na元素;b、d的最低负极为-2价,处于第ⅥA族,b的原子半径较小,故b为O元素,d为S元素;c、e的最高正价为+3,处于第ⅢA族,c的原子半径较小,故c为B元素、e为Al元素,
A.非金属性O>S,则对应氢化物稳定性:H2O>H2S,故A正确;
B.元素e的氧化物是氧化铝,属于两性氧化物,既可以与酸反应也可以与碱反应,故B错误;
C.同主族自上而下金属性增强,则金属性:f<g,故C正确;
D.元素a与元素d形成的化合物是H2S,属于共价化合物,故D正确;
故选B.
点评 本题考查原子结构与元素周期律的应用,题目难度中等,根据化合价与原子半径推断元素是解题关键,注意元素周期律的理解掌握,试题培养了学生的灵活应用能力.

练习册系列答案
 名牌学校分层周周测系列答案
名牌学校分层周周测系列答案 黄冈海淀全程培优测试卷系列答案
黄冈海淀全程培优测试卷系列答案
相关题目
7.用铁片与稀硫酸反应制取氢气时,下列措施不能使反应速率加快的是( )
| A. | 不用稀硫酸,改用98%浓硫酸 | B. | 改用热的稀硫酸溶液 | ||
| C. | 滴加少量CuSO4溶液 | D. | 不用铁片,改用铁粉 |
14.某有机化合物D的结构为 ,是一种常见的有机溶剂,它可以通过下列三步反应制得:烃A$→_{①}^{Br_{2}}$B$→_{②}^{NaOH溶液}$C$→_{③140℃}^{浓硫酸}$D,下列相关说法中正确的是( )
,是一种常见的有机溶剂,它可以通过下列三步反应制得:烃A$→_{①}^{Br_{2}}$B$→_{②}^{NaOH溶液}$C$→_{③140℃}^{浓硫酸}$D,下列相关说法中正确的是( )
 ,是一种常见的有机溶剂,它可以通过下列三步反应制得:烃A$→_{①}^{Br_{2}}$B$→_{②}^{NaOH溶液}$C$→_{③140℃}^{浓硫酸}$D,下列相关说法中正确的是( )
,是一种常见的有机溶剂,它可以通过下列三步反应制得:烃A$→_{①}^{Br_{2}}$B$→_{②}^{NaOH溶液}$C$→_{③140℃}^{浓硫酸}$D,下列相关说法中正确的是( )| A. | 烃A为CH3CH3 | B. | 反应②属于消去反应 | ||
| C. | 反应①②③都属于取代反应 | D. | 化合物D属于醚 |
4.下列说法不正确的是( )
| A. | 共价化合物形成的分子之间均存在分子间作用力 | |
| B. | SO2和SiO2的晶体类型不相同 | |
| C. | F2、Cl2、Br2、I2的熔沸点逐渐升高,是因为分子间作用力越来越大 | |
| D. | H2O的热稳定性大于H2S,是因为水分子间存在氢键 |
11.某原电池的离子方程式是 Zn+Cu2+=Zn2++Cu,该原电池正确的组成是( )
| 正极 | 负极 | 电解质溶液 | |
| A | C | Zn | ZnSO4 |
| B | Zn | Cu | CuSO4 |
| C | Cu | Zn | CuCl2 |
| D | Cu | Zn | ZnCl2 |
| A. | A | B. | B | C. | C | D. | D |
8.常温常压下,下列各组气体不能共存的是( )
| A. | SO2与O2 | B. | CO与O2 | C. | O2与N2 | D. | NO与O2 |
9.有机物种类繁多的原因之一是存在同分异构现象,下列分子式表示的物质不存在同分异构体的是( )
| A. | C6H6 | B. | C3H7Br | C. | C5H10 | D. | C2HCl5 |
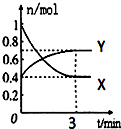 在一定温度下,体积为2L的密闭容器中,NO2和N2O4之间发生反应:2NO2(g)?N2O4(g)(无色),如图所示.
在一定温度下,体积为2L的密闭容器中,NO2和N2O4之间发生反应:2NO2(g)?N2O4(g)(无色),如图所示.